기억이 만들어지고, 되살아나고, 시간이 지남에 따라 퇴색해 가는 것을 깨닫는 일은 종종 시와 노래의 소재로 등장하곤 한다.
의학연구자들에게는 이 기억의 신비를 푸는 것이 훨씬 어렵다. 연구자들은 새로운 기억을 ‘보관하고’(laying down), 오래된 기억을 저장하는 것은 모두 하나의 뉴런이 다른 뉴런을 만나는 장소인 시냅스에서 단백질이 만들어지는 것이라고 추정하고 있다.
그러나 이런 일이 진행되려면 세포핵에서 새로운 유전자 발현이 필요하다. 세포핵에는 DNA가 저장돼 있고 세포가 자신에게 특별히 할당된 기능을 수행하기 위해서는 DNA 안에 있는 유전자가 ‘읽혀져야’ 한다.
최근 미국 펜실베이니아의대 연구팀은 쥐의 뇌에서 한 핵심적인 대사 효소가 뇌신경세포의 핵 안에 직접 작용해 새로운 기억이 확립될 때 유전자를 켜고 끈다는 사실을 발견했다. 이 연구 결과는 과학저널 ‘네이처’(Nature) 이번 주 온라인판에 발표됐다.
효소가 유전자와 결합해 학습과 기억 조절
이 대학 세포 및 발달생물학 교수이자 펜 발생기구 프로그램(the Penn Epigenetics Program) 이사인 셸리 버거(Shelley L. Berger) 박사는 “아세틸-코엔자임A 합성효소2 혹은 ACSS2라고 불리는 이 효소는 학습 후 핵심 기억 유전자를 활성화하기 위해 신경세포의 핵 안에서 ‘현장의’ 유전자 발현 기구 전체에 ‘불을 지핀다’”며, “우리는 ACSS2가 직접 유전자와 결합한다는 것과 뉴런 안에서 학습과 기억을 조절하는 역할을 한다는 두 가지 사실을 발견했다”고 밝혔다. 그는 두 가지 모두 전혀 예기치 않은 새로운 발견이었다고 덧붙였다.
버거 교수 연구실의 대학원생이었다 현재 마운트 사이나이의대 프리드만 뇌연구소 박사후 과정 연구원으로 있는 논문 제1저자 필립 뮤즈(Philipp Mews) 박사는 “이번 연구는 신경-후성적 기제(neuro-epigenetic mechanisms)가 핵심적인 것으로 알려진 불안이나 우울증 같은 신경정신 질환 치료를 위한 새로운 타깃을 제공한다”며, “우리는 ACSS2가 신경퇴행성 질환의 기억력 손상에도 어떤 역할을 한다고 의심하고 있다”고 밝혔다.
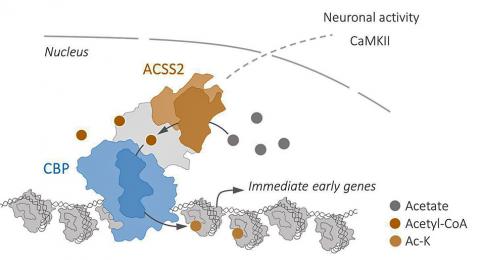
유전체 아세틸화로 인해 유전자 판독돼
기억 형성에는 시냅스의 재구성이 수반되는데, 이 재구성에는 기억 유전자 그룹의 조화로운 발현이 필요하다. 뉴런에 있는 유전체의 특정 부위에 아세틸화라는 화학적 과정이 부가되면 단단하게 감긴 DNA가 열려 기억 형성에 관여하는 유전자가 ‘판독’되고 결과적으로 부호화된 단백질이 만들어지게 된다.
유전자 발현에 영향을 미치는 화학물 그룹을 더하거나 빼는 신경생물학에서의 후성적 기제는 여러 뉴런들의 많은 기능을 조절하는 중요한 역할을 한다. 이번 연구에서 연구팀은 효소 ACSS2가 뉴런의 기억 유전자와 결합해 유전체의 아세틸화를 조절하고 촉발시킴으로써 궁극적으로 실험용 쥐의 공간 기억을 제어한다는 사실을 발견했다.
연구팀은 뇌 신경세포를 배양해 실험한 결과 ACSS2가 분화하는 뇌신경세포의 핵에서 증가하고, 고도로 발현된 유전자의 히스톤 아세틸화가 상승된 부위 근처에 모이는 것을 발견했다. 동시에, ACSS2의 감소는 핵에서의 아세틸-CoA의 수준과 아세틸화를 낮추고 그에 따라 기억 유전자의 발현을 낮추는 것으로 나타났다.

새로 발견한 기억 경로, 외상성 기억 막는데 응용 가능
다음으로, 연구팀은 실험용 쥐를 대상으로 연구하면서 동물의 ACSS2 발현이 막히면 대상이 어디 있는지를 기억하는 장기 기억이 손상된다는 사실을 발견했다. ACSS2 발현을 막은 쥐들은 그 이튿날 정상적인 대조군 쥐들이 옮겨진 대상을 찾기 위해 돌아다니는데 비해 그런 행동을 보이지 않았다.
이에 대해 뮤즈 박사는 “쥐에 ACSS2가 없어서 물체가 어디에 놓였었는지에 기억 유전자를 고정시키는 분자 경로가 없기 때문”이라고 설명했다. 결국 특정 뇌 영역에 있는 ACSS2가 줄어들면 새로운 기억을 형성하거나 오래된 기억을 갱신하는 핵심 유전자의 판독이 손상을 받게 된다.
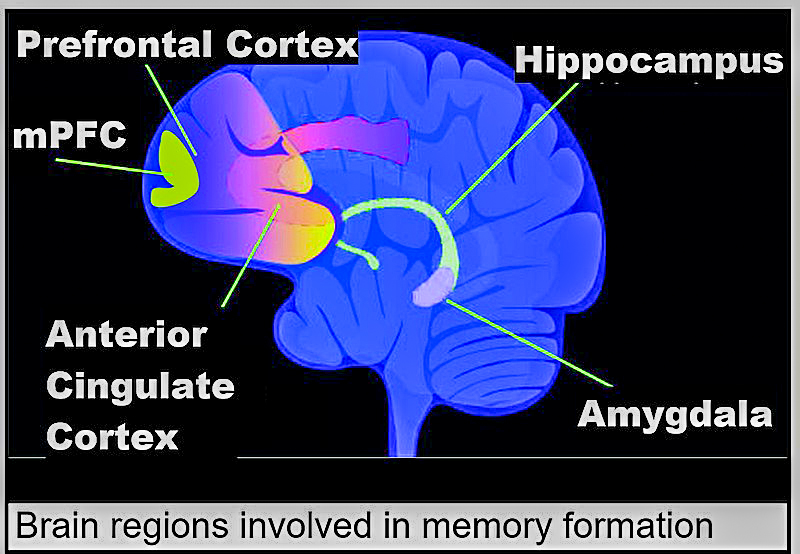
뮤즈 박사와 버거 교수는 앞으로 새로 발견한 기억 경로를 외상 후 스트레스 장애(PTSD)를 앓고 있는 환자들에게 적용해 이들의 외상성 기억이 보관되는 것을 막거나 혹은 이 기억들을 지우는데 응용하기를 희망하고 있다. 이는 장기 기억을 처리하는 뇌 영역인 해마에서 ACSS2를 차단함으로써 가능할 것으로 보인다.
- 김병희 객원기자
- kna@live.co.kr
- 저작권자 2017-06-01 ⓒ ScienceTimes
관련기사

 뉴스레터
뉴스레터