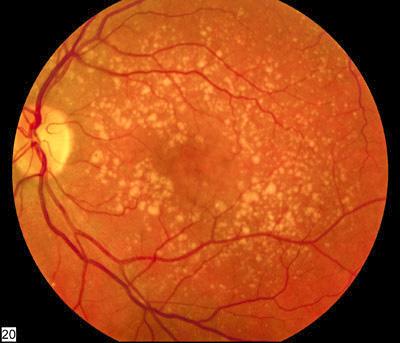
나이가 들면 눈에도 문제가 생긴다. 대표적인 눈 질환 중 하나가 눈의 망막 신경조직에 변성이 생겨 시력장애를 일으키는 노인성 황반변성(age-related macular degeneration, AMD)이다.
이 노인성 황반변성을 유전자 치료로 부작용 없이 치료할 수 있다는 실험적 연구가 나왔다.
미국 존스홉킨스대 의학자들이 주도한 공동연구진은 소규모의 예비적인 임상시험에서 바이러스를 이용해 눈에 치료 유전자를 도입하는 실험적인 유전자 치료가 안전하며, 습성 노인성 황반변성 환자들의 시력을 보존하는데 효과적이라는 사실을 확인해 의학저널 ‘랜싯’(The Lancet) 16일자에 발표했다.
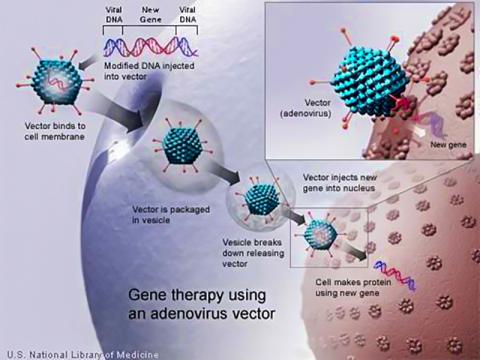
바이러스를 운반체로 이용해 유전자 주입
연구팀이 활용한 바이러스는 일반 바이러스와 비슷한 종류로 질병을 일으킬 수 없도록 실험실에서 변형됐다. 이 바이러스는 망막세포를 관통해 들어가 세포가 sFLT01이라 불리는 치료 단백질을 생산하도록 전환시키는 유전자를 집어넣는다.
습성 황반변성은 망막에서 혈관 내피 성장인자(VEGF) 생성이 늘어나 비정상적인 혈관이 자라나기 때문에 생긴다. 현재의 치료법은 치료 단백질을 직접 눈에 주사해 이 단백질이 VEGF와 결합해 비활성화시키고 황반부의 수분을 줄이면서 시력을 향상시키도록 하는 방법이다.
그러나 이 치료 단백질은 눈에서 입으로 통하는 통로를 통해 빠져나오므로 환자들은 6~8주마다 병원에 가서 다시 주사를 맞아야 하는 번거로움이 있다. 안과 전문의들은 많은 환자들이 이 처방에 대한 부담과 불편함 때문에 제 때 주사를 맞지 않아 시력을 잃어버린다고 말한다.
망막세포에서 치료용 단백질 생성
연구팀은 바이러스가 세포에 침투해 유전물질을 남기는 원리를 이용해 바이러스가 망막 세포를 표적으로 뚫고 들어가 sFLT01를 생성하는 유전자를 넣을 수 있도록 설계했다. 이렇게 되면 망막세포가 치료용 단백질을 만드는 공장 역할을 하므로 외부에서 치료 단백질을 주입할 필요가 없게 된다.
피터 캠퍼치아로(Peter Campochiaro) 존스홉킨스대 안과 교수는 “이번 연구는 규모는 작지만 새로운 치료법 개발을 위한 가능성을 열었다”며, “환자가 치료를 위해 자주 병원을 방문하고 처방에 따르는 불편을 감수해야 하는 어려움을 줄일 뿐만 아니라 시력 보전을 위해 VEGF를 지속적으로 억제할 수 있어 장기적으로 증상을 개선할 수 있다”고 말했다. 그는 “바쁜 생활 속에서 반복적으로 주사를 맞는 일도 쉽지 않다”고 덧붙였다.

VEGF와 결합해 혈관 생성 막아
이번 연구의 1단계 임상시험에는 황반변성이 진행된 50세 이상의 남녀 19명이 참여했다. 참가자들은 다섯 그룹으로 나눠 0.05 mL 용액에 바이러스 입자가 2X10^8개에서 2X10^10개까지 들어있는 유전자 치료액을 투여했다. 연구팀은 다음 그룹에 더 높은 용량을 투여하기 전에 적어도 4주간 치료액을 투여받은 그룹에서 이상 반응이 없는지를 살펴봤다.
관찰 결과 바이러스가 유전자를 운반해 집어넣은 후 망막 세포들이 치료 단백질인 sFLT01를 분비하기 시작했다. 이 단백질들은 VEGF와 결합해 비정상적인 혈관의 누출이나 성장을 자극하지 못 하도록 했다. 연구팀의 목표는 바이러스에 감염된 망막세포가 AMD 진행을 영구히 막을 수 있는 충분한 치료 단백질을 생산토록 하는 것이다.
독성 없고 안전성 확인돼
연구팀은 처음 3개 그룹을 모니터링한 후 용량을 제한할 만한 독성이 없다는 것을 확인하자 10명의 참가자가 있는 그룹에 최대 용량을 투여했다. 그러나 심각한 부작용은 관찰되지 않았다. 캠퍼치아로 교수는 “최고 용량에서도 치료는 매우 안전했고, 환자들에게 거의 부작용이 없다는 것을 확인했다”고 말했다.
시험 참가 그룹은 현재 시행되는 표준치료법에 의해 시력이 거의 회복되지 않는 ‘어려운’ 환자들로 구성됐다. 이에 따라 19명 중 11명 정도만이 치료에 반응을 보일 가능성이 있었다. 이 11명 중 4명에게서 극적인 치료 효과가 나타났다. 캠퍼치아로 교수는 이들의 눈에 있는 심각한 수준의 체액이 최적의 표준치료를 했을 때 볼 수 있는 것처럼 거의 제로상태로 떨어졌다고 밝혔다. 이와 함께 다른 참가자 두 명에게서도 체액의 양이 부분적으로 줄어들었다.
바이러스에 대한 인체 면역 항체가 걸림돌
11명 중 5명에게서는 체액이 줄어들지 않았는데, 연구진은 놀랍게도 개선을 보이지 않은 모든 환자가 AAV2 바이러스에 대한 항체를 가지고 있다는 사실을 발견했다.
연구진은 이 같은 사실을 들어 추가적인 연구를 통해 유전자 치료의 안전성과 가치를 확인한다 해도 광범위하게 활용하기에는 한계가 있다는 결론을 내렸다. 그 이유는 미국의 경우 인구의 60% 정도가 AAV2 바이러스가 속한 아데노 관련 바이러스에 감염돼 면역력을 갖고 있기 때문이다.
연구팀은 효과를 보이지 않은 환자들의 면역계가 치료 유전자를 삽입하기 전 운반체인 바이러스를 파괴했다고 믿고 있다. 캠퍼치아로 교수는 “이번 연구에서는 대상 환자의 수가 적어 단순한 상관관계만을 보여주기 때문에 혈청 항체가 결정적인 장애가 되는지는 알 수 없다”며, “이 부분을 명확히 알기 위해서는 더 많은 연구가 필요하다”고 말했다.
- 김병희 객원기자
- kna@live.co.kr
- 저작권자 2017-05-17 ⓒ ScienceTimes
관련기사

 뉴스레터
뉴스레터