세포 노화와 DNA 복구의 핵심 단계가 분자 수준에서 밝혀졌다.
DNA 복구는 세포의 활력과 생존, 암 예방에 필수적이다. 손상된 DNA를 수리하는 능력은 나이가 들면서 줄어들지만 그 이유는 지금까지 완전히 밝혀지지 않았었다.
미국 하버드의대 연구진은 최근 세포가 손상된 DNA를 수선하는 일련의 분자적 연쇄 과정 가운데 핵심적인 단계를 밝혀내 과학저널 ‘사이언스’(Science) 24일자에 발표했다.
이번 연구는 DNA를 수리하는 인체의 능력이 시간이 지남에 따라 어떻게 그리고 왜 줄어드는지에 대한 중요한 통찰력을 제시하는 한편, 신호 분자인 NAD가 DNA 복구에서 일어나는 단백질 간 상호작용의 핵심 조절자라는, 지금까지 알려지지 않았던 사실을 밝혀냈다. NAD는 이미 한 세기 전부터 세포를 손상시키는 산화의 조절 인자로 알려져 있다.
이번 연구는 또 쥐에 대한 실험에서 NAD 전구체인 NMN으로 치료하면 노화 관련 DNA 손상을 완화시키고, 방사선 노출로 인한 DNA 손상을 방지한다는 사실을 보여주었다.

“세포 변성과 노화의 핵심 기전 밝혀”
인간과 쥐는 생물학적 차이가 있기 때문에 치료 물질의 효과가 때로 매우 다르게 나타날 수 있다. 그러나 더 많은 동물실험과 사람 대상 임상실험에서 효과가 확인되면 노화나 암 치료와 관련해서 일어나는 DNA 손상 예방을 위한 치료법 개발에 도움을 줄 수 있을 것으로 보인다.
암 치료에서 종양을 사멸시키기 위해 쓰이는 방사선 요법과 몇몇 화학요법들은 건강한 세포에도 심한 DNA 손상을 입힐 수 있다.
연구팀은 NMN을 이용해 DNA 손상을 방지하는 인체 실험이 6개월 이내에 시작될 것으로 예상하고 있다.
논문의 시니어 저자인 데이비드 싱클레어(David Sinclair) 교수(유전학, 호주 뉴사우스웨일즈의대 교수 겸직)는 “이번 연구는 세포 변성과 노화의 핵심 기전을 밝혀내고 나아가 노화와 방사선에 의해 유발되는 DNA 손상을 멈추고 역전시키는 치료 방향을 제시했다”고 말했다.
싱클레어 교수는 이전에 쥐를 대상으로 한 연구에서 NMN이 근육 노화를 역전시킨다는 사실을 밝혀낸 바 있다.
세포 노화 관련된 다양한 단백질과 분자 연구
연구진은 먼저 세포 노화과정에 관여하는 것으로 생각되는 단백질과 분자의 면면을 관찰하는 것부터 시작했다. 이들 중 일부는 잘 알려진 ‘캐릭터’였으나 다른 일부는 수수께끼같은 존재였다.
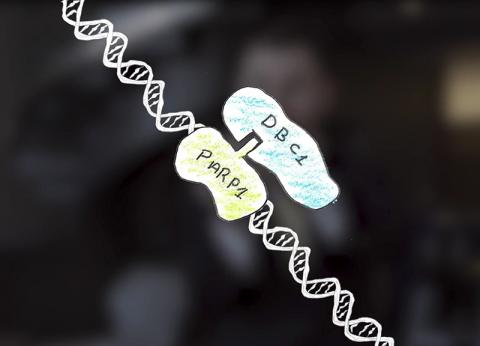
연구팀은 나이를 먹어감에 따라 꾸준히 줄어드는 NAD가 효모와 파리, 쥐에 대한 실험에서 노화를 지연시키고 수명을 연장하는 SIRT1 단백질의 활성을 증가시킨다는 사실을 이미 알고 있었다. DNA 복구를 조절하는 것으로 알려진 SIRT1과 PARP1 단백질은 작업 과정 중에 NAD를 소모한다.
또다른 단백질인 DBC1은 인체에서 가장 풍부한 단백질 중 하나이고 박테리아에서 동식물에 이르는 수많은 생명체에서 발견되는 종류로, 정체가 훨씬 불분명했다. DBC1은 이전에 활력을 증진하는 SIRT1을 억제하는 것으로 나타났기 때문에 PARP1과 SIRT1이 비슷한 역할을 한다면 DBC1은 PARP1과 어느 정도 상호 작용을 할 수 있을 것으로 생각됐다.
논문 제1저자인 준 리(Jun Li) 하버드의대 유전학부 연구원은 “SIRT1와 DBC1 사이에 연결이 있고, 또 SIRT1과 PARP1이 연결된다면 PARP1과 DBC1 또한 어떤 종류의 세포 내 게임에 결부돼 있을 것이라고 생각했다”고 밝혔다.
나이 들어 NAD 수치 줄어들면 세포 손상과 돌연변이 등 유발
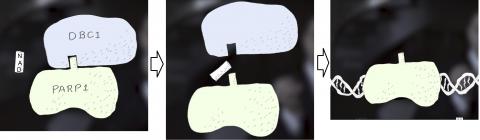
실제로 그랬다. 이 세 단백질 간의 화학적 관계를 더욱 잘 이해하기 위해 연구진은 인체 신장세포 안에서 단백질과 단백질 간 상호작용을 나타내는 분자 표지들을 측정했다. 그 결과 DBC1과 PARP1은 서로 강력하게 결합했으나 NAD 수치가 증가하면 그 결합이 깨졌다. 세포 안에 더 많은 NAD가 존재할수록 PARP1과 DBC1이 형성할 수 있는 분자 결합은 줄어들었다.
반대로 연구팀이 NAD를 억제하면 PARP1-DBC1 결합의 수는 늘어났다. 즉, NAD가 많으면 DBC1이 PARP1에 결합하는 것을 방해하고 손상된 DNA를 수선하는 능력에 관여하게 된다.
연구팀은 이것이 나이가 들면서 NAD가 감소함에 따라 DBC1과 PARP1 사이의 유해한 상호작용을 멈추게 할 NAD 분자 수가 더욱 더 줄어든다는 점을 시사한다고 말했다. 그 결과 DNA 멈춤 같은 사태가 복구되지 않고, 시간이 지남에 따라 이런 멈춤 사태가 쌓여 세포 손상과 세포 돌연변이, 세포 사멸 및 기관 기능 상실을 촉진하게 된다.
NAD, 많은 생물종에서 DNA 수리와 세포 생존에 관여
연구팀은 다음으로 NAD가 PARC1과 DBC1의 결합을 차단하는 방법을 정확히 이해하기 위해 NHD로 알려진 DBC1의 영역을 탐구했다. 이것은 생명체와 여러 종들을 통틀어 약 8만개의 단백질에서 발견되는 주머니 같은 구조로, 그 기능에 대해 과학자들은 정확히 알지 못 했다.
연구팀은 실험을 통해 NHD가 NAD의 결합 사이트이고, NAD가 DBC1에서 이 특정영역을 차단함으로써 DBC1이 PARP1과 결합해 DNA 복구를 방해하지 못 하도록 한다는 것을 보여주었다.
싱클레어 교수는, NHD가 여러 종 전체에 걸쳐 매우 흔하기 때문에 NAD가 많은 종에서 유해한 단백질 상호작용을 막는 유사한 역할을 통해 DNA 수리와 다른 세포 생존 과정을 제어할 수 있다고 덧붙였다.
NMN 처치 받은 늙은 쥐, 젊은 쥐와 NAD 수치 같아져
연구팀은 단백질들이 실험실 밖의 살아있는 유기체에서 어떻게 상호작용하는지를 확인하기 위해 젊은 쥐와 늙은 쥐에게 NAD 전구체인 NMN을 주입해 봤다. NMN은 NAD 분자의 절반 정도 크기로 구성돼 있다. NAD 분자는 너무 커서 세모막을 통과할 수 없으나 NMN은 쉽게 통과할 수 있다. 일단 세포 안으로 들어간 NMN은 다른 NMN 분자와 결합해 NAD를 형성한다.
예상대로 늙은 쥐의 간에서는 NAD와 PARP1 수치가 낮게 나왔고, 등 뒤에서는 PARP1과 DBC1 수치가 높았다.
그러나 일주일 동안 식수에 NMN을 타 먹인 늙은 쥐는 NAD 수치와 PARP1 활성 모두에서 현저한 차이를 보였다. 늙은 쥐의 간에서 NAD 수치는 젊은 쥐의 수치와 유사하게 나타났다. 또 NMN 처치를 받은 쥐의 세포들은 PARP1의 활성이 증가됐고, PARP1과 DBC1 결합은 더 적어졌다. 이와 함께 쥐들에게서 DNA 손상을 나타내는 분자 표지도 줄어든 것으로 나타났다.
NAD, 방사선 피폭 치료제로 활용 가능
마지막 단계로 연구팀은 DNA를 손상시키는 방사선에 쥐들을 노출시켰다. 미리 NMN을 처치한 쥐의 세포는 손상 수준이 낮았다. 이 쥐들은 또 백혈구 수 변화와 림프구 및 헤모글로빈 수치의 변화와 같은 전형적인 방사선 유발 문제를 나타내지 않았다. 이 같은 보호 효과는 방사선에 노출된 후 NMN을 처치한 쥐에서도 나타났다
이 결과들은 DNA 손상에 의한 세포 파괴의 기전을 설명해 준다. 아울러 NMN 처치를 통한 NAD 수치 회복은 암 치료에 따른 방사선 노출뿐만 아니라 환경 방사선의 부작용을 피할 수 있는 가능한 치료법으로서 더 연구될 필요가 있음을 시사한다.
지난해 12월 싱클레어 랩과 리버티 바이오시큐어리티는 미국 항공우주국(NASA)의 iTech 공모전에 공동 프로젝트를 제출해 우주 비행 중 받는 우주 방사선 피폭의 치료법으로 NAD 증폭 분자를 사용하는 개념으로 국가 우승자가 됐다.
- 김병희 객원기자
- kna@live.co.kr
- 저작권자 2017-03-24 ⓒ ScienceTimes
관련기사

 뉴스레터
뉴스레터