면역계의 역설: 강력함과 자제력의 균형
2025년 노벨 생리의학상은 면역계가 우리 몸을 공격하지 않도록 조절하는 핵심 메커니즘을 밝혀낸 세 명의 과학자에게 돌아갔다. Mary E. Brunkow, Fred Ramsdell, Shimon Sakaguchi는 조절 T세포(regulatory T cells)와 이를 제어하는 FOXP3 유전자를 발견함으로써 말 그대로 면역학의 패러다임을 바꾸어 놓았다는 평가를 받고 있다.

우리 몸의 면역계는 매일 수천 가지의 바이러스와 세균으로부터 우리를 지켜내는 강력한 방어 시스템이다. 그러나 이처럼 강력한 무기가 자칫 잘못 작동하면 우리 몸의 정상 조직을 공격하는 자가면역질환을 일으킬 수 있다. 20세기 초 파울 에를리히(Paul Ehrlich)가 "공포의 자가독성(horror autotoxicus)"이라 명명한 이 현상은 오랫동안 면역학자들을 괴롭혀왔다. 이번 수상자들의 발견은 면역계에 '가속 페달'뿐만 아니라 정교한 '브레이크 시스템'이 존재한다는 것을 명확히 보여주었다. 이들의 연구는 자가면역질환, 장기이식 거부반응, 그리고 암 치료에 이르기까지 광범위한 임상적 응용 가능성을 열어주고 있다.

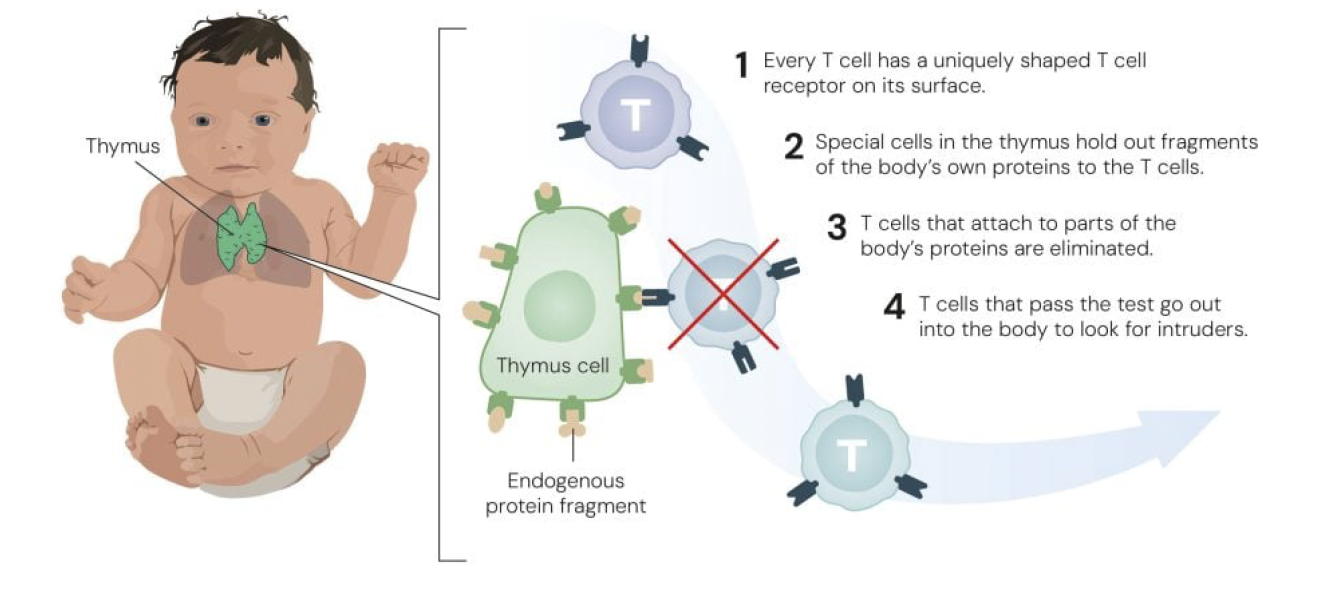
인간의 면역계는 말 그대로 진화의 걸작이다. T세포와 B세포는 각각 고유한 항원 수용체를 가지고 있으며, 이론적으로 10^15개 이상의 서로 다른 수용체를 만들어낼 수 있다. 1987년 노벨상 수상자인 도네가와 스스무(Susumu Tonegawa)는 V(variable), D(diversity), J(joining) 유전자들이 조합되어 이러한 엄청난 다양성을 만들어낸다는 것을 밝혀냈다. 하지만, 이 무작위적인 조합 과정은 필연적으로 문제를 야기한다. 일부 T세포는 우연히 자기 몸의 정상 조직을 인식하는 수용체를 갖게 되는 것이다. 1980년대까지 과학자들은 흉선(thymus)에서 일어나는 '중심 관용(central tolerance)' 메커니즘만으로 이 문제가 해결된다고 믿었다. 흉선에서 자가반응성 T세포들이 제거된다는 것이다.
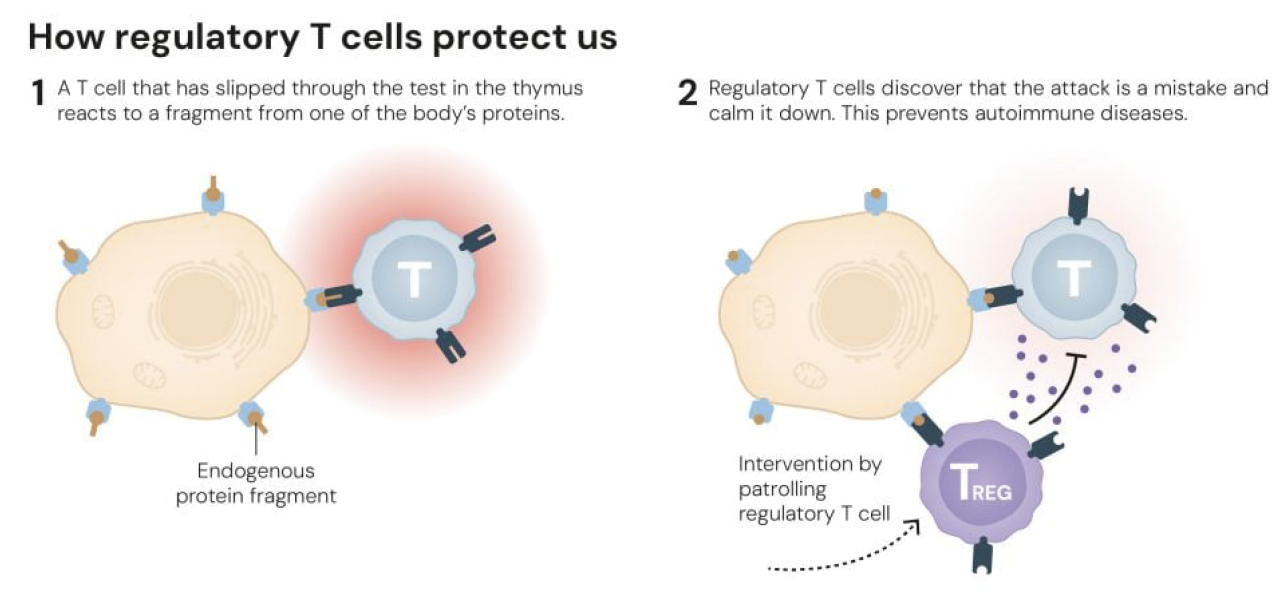
1987년 피터 도허티(Peter Doherty)와 롤프 징커나겔(Rolf Zinkernagel)은 T세포가 MHC 분자와 결합한 항원만을 인식한다는 'MHC 제한(MHC restriction)' 개념을 확립하여 노벨상을 수상했다. 2002년에는 마크 앤더슨(Mark Anderson), 크리스토프 브누아(Christophe Benoist), 다이앤 마티스(Diane Mathis)가 AIRE 유전자가 흉선에서 조직 특이적 항원들을 발현시켜 자가반응성 T세포를 제거한다는 것을 밝혀냈다. 물론 중심 관용만으로는 충분하지 않았다. 일부 자가반응성 T세포들은 흉선의 선별 과정을 빠져나가 말초 혈액으로 진입한다. 그렇다면 이들은 어떻게 통제되는가? 이 질문에 대한 답이 바로 말초 면역 관용(peripheral immune tolerance)이며, 그 핵심에 조절 T세포가 있다.
Sakaguchi의 집요한 추적: CD4+CD25+ 세포의 발견
1970년대 '억제 T세포(suppressor T cells)'라는 개념이 제시되었으나, 실험 결과의 재현성 문제와 일부 데이터 조작 사건으로 인해 이 분야는 거의 폐기 직전까지 갔다. 그러나 일본 나고야의 아이치 암센터에서 연구하던 사카구치 시몬은 다른 방향을 택했다. 사카구치의 영감은 1969년 니시즈카 야스아키(Yasuaki Nishizuka)와 사카쿠라 테루요(Teruyo Sakakura)의 실험에서 나왔는데, 그들은 생후 3일 된 생쥐의 흉선을 제거하면 난소 기능 장애와 함께 다양한 자가면역질환이 발생한다는 것을 발견했다. 역설적이게도 면역 기관을 제거했는데 면역 과잉 반응이 일어난 것이다.
1982년 사카구치와 니시즈카는 정상 생쥐의 특정 면역세포 분획을 흉선 제거 생쥐에 주입하면 자가면역질환을 예방할 수 있다는 것을 보였다. 이는 면역계 내부에 '보안 요원' 역할을 하는 세포 집단이 존재한다는 강력한 증거였다. 10년 이상의 집요한 연구 끝에, 사카구치는 1995년 Journal of Immunology에 획기적인 논문을 발표했다. CD4 양성이면서 동시에 IL-2 수용체의 알파 사슬인 CD25를 발현하는 T세포 집단이 면역 조절 기능을 담당한다는 것이었다.
실험은 명확해서 이해하기 어렵지 않다. Balb/c 누드 생쥐(면역결핍 생쥐)에 CD25가 제거된 CD4+ T세포만 주입하면 갑상선염, 위염, 췌장염, 관절염 등 전신적 자가면역질환이 발생했다. 그러나 CD4+CD25+ T세포를 함께 주입하면 이러한 질병이 예방되었다. 자가면역질환을 일으키는 자가항체(항갑상선글로불린 항체, 항위벽세포 항체)의 생성도 CD4+CD25+ 세포에 의해 억제되었다.
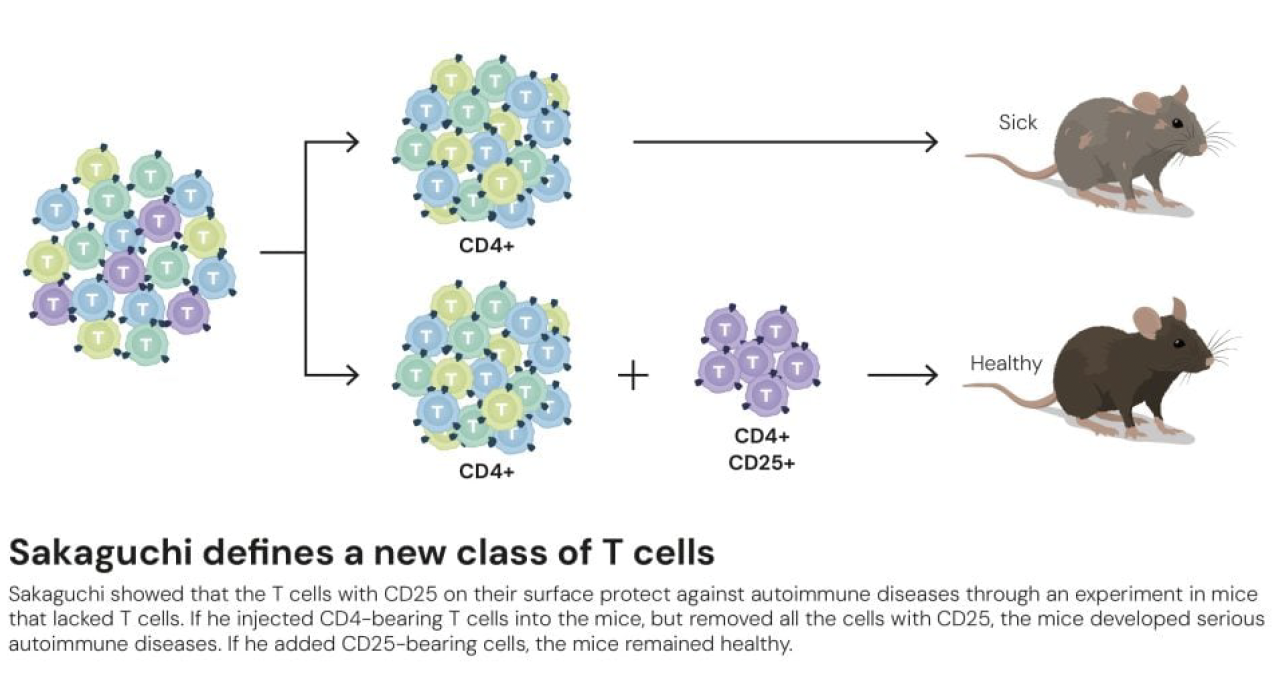
이 발견은 곧 미국 국립보건원의 에단 셰박(Ethan Shevach)과 영국 옥스퍼드대학의 피오나 파우리(Fiona Powrie) 연구팀에 의해 독립적으로 확인되었다. 비로소 조절 T세포의 존재가 명확히 입증된 것이다.
Brunkow와 Ramsdell의 집념: 유전자 사냥의 대장정
같은 시기, 미국 워싱턴주 보텔의 셀테크 키로사이언스(Celltech Chiroscience)에서 메리 브런코와 프레드 램스델은 전혀 다른 접근법으로 같은 문제를 추적하고 있었다. 그들의 출발점은 '스커피(scurfy)' 돌연변이 생쥐였다. 스커피 생쥐는 1940년대 오크리지 국립연구소의 맨해튼 프로젝트 중 방사선 연구 과정에서 우연히 발견된 돌연변이 계통이다. 수컷 스커피 생쥐는 비늘 같은 피부, 비정상적으로 비대해진 비장과 림프절을 보이며 생후 몇 주 만에 사망했다. 유전학적 분석 결과 이 돌연변이는 X염색체에 위치하며, 암컷은 보인자로서 돌연변이를 다음 세대로 전달하지만 증상은 나타나지 않았다.
1990년대 브런코와 램스델은 스커피 생쥐가 자가면역질환 연구에 중요한 단서를 제공할 수 있다고 판단했다. 그들은 원인 유전자를 찾기로 결심했으나, 당시 기술로는 이것이 건초더미에서 바늘 찾기나 다름없었다. 생쥐 X염색체는 약 1억 7천만 개의 염기쌍으로 구성되어 있기 때문이다. 먼저 이들은 후보 영역을 약 50만 염기쌍으로 좁혔다. 이 영역에서 박테리아 인공염색체(BAC) 클론 11개를 분리하고, 약 20개의 유전자를 확인했다. 그리고 각 유전자를 하나씩 시퀀싱하여 정상 생쥐 7개 계통 및 인간 유전자와 비교했다.
마지막 20번째 유전자를 분석할 때 마침내 "빙고"를 외칠 수 있었다고 한다. 스커피 생쥐에서 2개 염기쌍 삽입(insertion)으로 인한 프레임시프트(frameshift)와 조기 종결 코돈이 발견되었기 때문인데, 이 유전자는 DNA 결합 도메인을 가진 포크헤드 박스(forkhead box) 전사인자 계열에 속했고, 그들은 이에 해당 유전가를 Foxp3라고 명명했다.
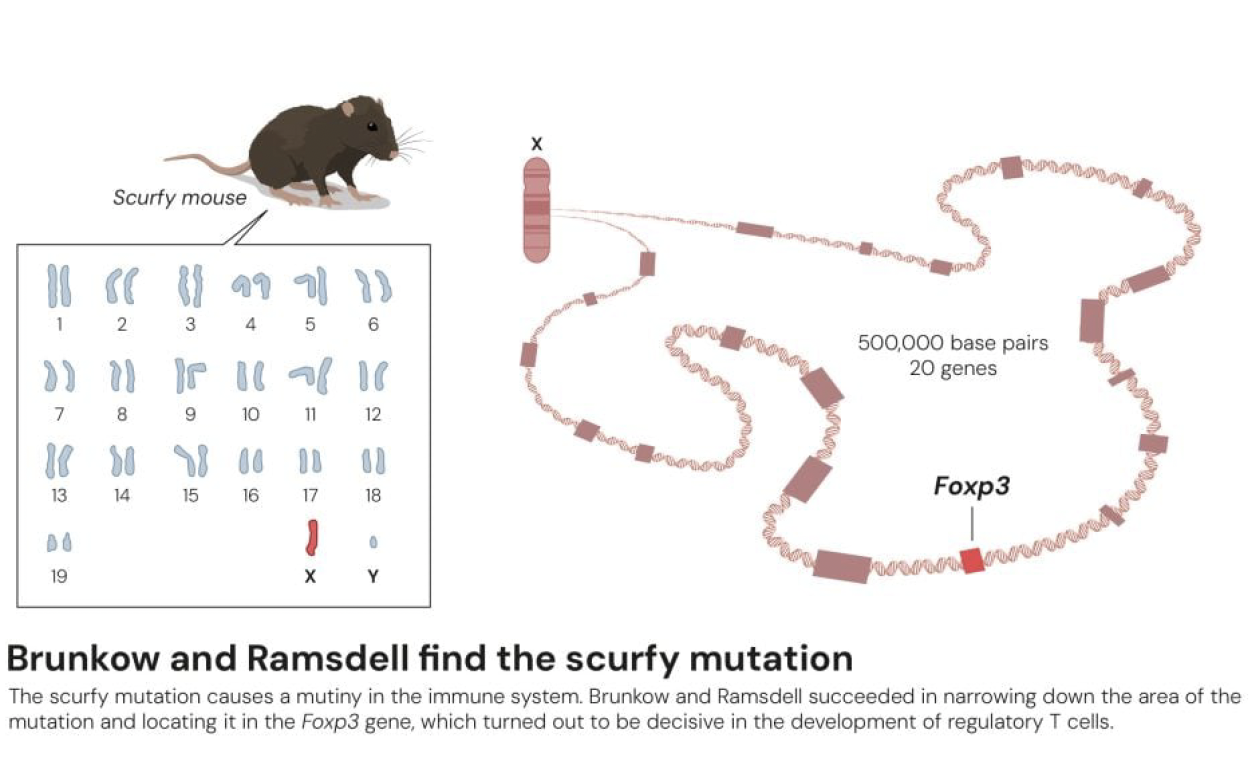
하지만 과학자로서 이들은 이것이 진정한 원인 유전자임을 증명해야 했다. 원인과 결과 그리고 명확한 이해가 없으면 발견만으로는 의미가 없기 때문이다. 브런코와 램스델은 정상 Foxp3 유전자를 가진 형질전환 생쥐 5개 계통(각각 다른 유전자 복제수를 가짐)을 만들고 스커피 생쥐와 교배했다. 이들은 해당 실험을 통해서 정상 Foxp3 유전자가 수컷 스커피 생쥐를 질병으로부터 완전히 구제함을 발견했다.
더 나아가 그들은 인간에게서도 같은 메커니즘이 작동한다는 것을 입증했다. IPEX(면역조절장애, 다발성내분비병증, 장병증, X-연관) 증후군은 남아에게서 치명적인 자가면역질환을 일으키는 희귀 유전병이다. 2001년 Nature Genetics에 발표된 두 편의 논문에서 브런코와 램스델(워싱턴대학 소아과의 한스 옥스(Hans Ochs) 및 오리건보건과학대학의 로버트 윌딘(Robert Wildin)과 공동연구)은 IPEX 환자들이 FOXP3 유전자 돌연변이를 가지고 있음을 밝혀냈다.
퍼즐의 완성: Foxp3와 조절 T세포의 연결
두 발견 사이의 연결고리는 신속하게 확립되었다. 2003년 사카구치 팀은 Science에 Foxp3가 CD4+CD25+ T세포에서 선택적으로 발현되며, Foxp3를 일반 CD4+ T세포에 도입하면 조절 T세포로 전환된다는 것을 보였다. 같은 해 램스델 그룹은 스커피 생쥐에 조절 T세포가 결핍되어 있으며, Foxp3를 과발현하는 생쥐는 조절 T세포가 증가한다는 것을 확인했다. 하워드휴즈의학연구소의 알렉산더 루덴스키(Alexander Rudensky)는 Foxp3 결핍 생쥐를 만들어 스커피와 동일한 표현형을 보인다는 것을 입증했다.
결정적으로, 루덴스키 팀은 2005년 T세포 구획에서만 Foxp3를 제거해도 초기 발병 림프증식성 증후군과 자가면역이 유도된다는 것을 보였다. 즉, 단 하나의 세포 타입(조절 T세포)이 없고, 단 하나의 유전자 좌위(Foxp3)가 결함이 있으면 생쥐와 인간 모두에서 관용이 깨지고 "공포의 자가독성"이 발생한다는 것이 명확해졌다. Foxp3는 전사인자로서 조절 T세포의 발달과 기능을 특징짓는 수백 개 유전자의 발현을 조율한다. 조절 T세포는 세포 대 세포 접촉 의존적 상호작용, IL-10, IL-35, TGF-β 같은 억제성 사이토카인 분비, 그리고 IL-2 격리를 통해 다른 T세포의 증식과 사이토카인 생산을 억제한다.
임상적 응용 그리고 남은 과제들
조절 T세포의 발견은 즉시 치료적 응용 가능성을 제시하고 있다. 자가면역질환에서는 조절 T세포를 증강시키고, 암에서는 종양 침윤 조절 T세포를 제거하여 항종양 면역을 강화할 수 있다.
현재 200개 이상의 임상시험이 진행 중이다. 먼저 자가면역질환 및 이식 거부 억제를 위한 임상시험들이 있다. 환자 자신의 조절 T세포를 체외에서 IL-2로 자극하여 증폭시킨 후 재주입하는 방법이 제1형 당뇨병, 염증성 장질환 환자를 대상으로 시험되고 있다. 저용량 IL-2 또는 IL-2 수용체 작용제인 레즈페갈데슬루킨(Rezpegaldesleukin)을 투여하여 생체 내에서 조절 T세포를 직접 증가시키는 방법도 있다. 2024년 발표된 무작위 대조 임상시험에서 레즈페갈데슬루킨은 중등도에서 중증 아토피피부염 환자에게 효과를 보였다.
키메라 항원 수용체 조절 T세포(CAR-Treg)는 특정 항원을 표적하는 항체 도메인을 발현하도록 조절 T세포를 조작하여 이식 장기나 특정 조직으로 면역 억제 활성을 유도한다. T세포 수용체 조절 T세포(TCR-Treg)는 셀리악병(celiac disease)처럼 병원성 에피토프가 알려진 질환에서 특이적 관용을 유도하기 위해 개발되고 있다.
암치료를 위한 임상시험들도 다양하다. 종양 미세환경에는 다량의 조절 T세포가 침윤되어 있어 항종양 면역을 억제한다. 2016년과 2022년 연구들은 CCR8이 종양 침윤 조절 T세포에 선택적으로 발현된다는 것을 밝혀냈다. 이에 따라 항CCR8 단일클론항체가 개발되어 임상시험이 진행 중이다. 이 접근법의 핵심은 전신의 조절 T세포를 고갈시키지 않고 종양 내 조절 T세포만 선택적으로 제거하여 자가면역 부작용을 최소화하는 것이다.
조절 T세포 연구는 여전히 활발히 진행 중이다. 흉선 유래 조절 T세포(tTreg)와 말초 유도 조절 T세포(pTreg), 그리고 체외 유도 조절 T세포(iTreg) 간의 차이와 안정성 문제가 계속 연구되고 있다. 인간 조절 T세포는 생쥐보다 더 복잡하여, 활성화된 일반 CD4+ T세포도 일시적으로 FOXP3를 발현할 수 있다. 조절 T세포가 흉선에서 선택되는 정확한 메커니즘, 친화도(affinity) 역치가 세포 사멸과 조절 T세포 분화를 결정하는지 여부 등도 여전히 논쟁 중이다. 2021년 사카구치 팀은 FOXP3 발현을 조절하는 비암호화 유전 요소들을 규명했으며, 2025년에는 FOXP3를 음성 조절하는 억제 복합체들을 밝혀내어 체외 iTreg 생산 프로토콜 개선에 기여하고 있다. 염증 환경에서의 조절 T세포의 행동도 중요한 연구 주제가 될 수 있다. 2025년 발표된 연구에 따르면 염증 조직 내 조절 T세포는 기능 유지를 위해 Foxp3에 더 크게 의존한다고 한다. 이는 자가염증질환 치료에 중요한 시사점을 제공해주고 있다.
- 김민재 리포터
- minjae.gaspar.kim@gmail.com
- 저작권자 2025-10-15 ⓒ ScienceTimes
관련기사

 뉴스레터
뉴스레터