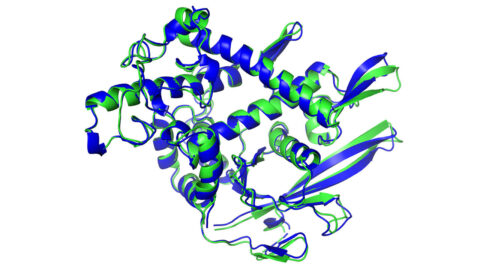
단백질(protein)은 사람을 비롯한 모든 생명체를 구성하고 있는 주성분이다.
그 속을 들여다보면 20종의 아미노산이 수십, 혹은 수백 개로 연결돼 있으면서 무수하게 밀고 당기는 방식으로 복잡한 3D 모양을 생성하고 있다.
이 같은 단백질 모양은 각종 질병과 밀접한 관련이 있다. 그런 만큼 과학자들은 그 모양을 알게 되면 단백질 내에 주입할 수 있는 약물을 개발해 난치병을 치료하는데 큰 도움을 줄 수 있을 것으로 판단해왔다.
“생명과학에 혁명을 일으킬 만큼 큰 잠재력”
또 바이오 연료, 폐 플라스틱 분해 등 다양한 용도로 활용이 가능하다고 판단해왔다.
이 난제를 인공지능(AI)이 해결했다.
1일 ‘사이언스’, ‘BBC’ 등 주요 언론들은 런던에 기반을 둔 AI연구소 딥마인드(DeepMind)에서 인공지능을 통해 단백질 구조를 밝혀냈다고 보도했다.
아미노산 선형 사슬이 3D 형태로 구부러져 활동하고 있는 방식을 예측하는데 성공했다는 것. 2년마다 개최되는 국제 단백질 구조 예측 대회(CASP)에 참석하고 있는 연구진은 “이번 연구 결과가 향후 새로운 약물 개발에 큰 도움을 줄 수 있을 것”이라고 말했다.
CASP 공동 창립자인 메릴랜드 대학의 구조생물학자 존 몰트(John Moult) 교수는 “딥 마인드 연구팀이 향후 백질 연구의 미래를 바꿀 환상적인 연구 결과를 발표했다.”고 말했다.
CASP의 과학 심사위원 패널 중 한 명인 캘리포니아 대학(UC)의 앤드리 크루슈타포비치(Andriy Kryshtafovych) 교수는 “단백질의 형태를 빠르고 정확하게 조사할 수 있다는 것은 생명 과학에 혁명을 일으킬 만큼 큰 잠재력이 있다."며 놀라움을 표명했다.
‘사이언스’ 지에 따르면 단백질 구조분석에 관심을 갖게 된 것은 1960년대다.
연구자들은 단백질 내에서 발생하는 개별적인 상호작용을 이해할 수 있다면 표면적으로 나타나는 단백질의 3D 형태를 예측할 수 있다는 것을 깨달았다.
그러나 하나의 단백질 내에 수십, 수백 개의 아미노산과 각 아미노산 쌍이 상호 작용할 수 있는 가능성은 천문학적인 규모였다. 많은 과학자들이 연구에 뛰어들었지만 이를 계산해내는데 너무 많은 시간이 걸리면서 속도가 느리게 진행됐다.
이런 상황에서 1994년 메릴랜드 대학의 존 몰트 교수와 그의 동료들은 국제 단백질 구조 예측 대회(CASP)를 창안한다. 그리고 2년마다 개최되는 이 대회를 통해 구조가 알려지지 않았던 아미노산 서열을 획득했다.
딥마인드 ‘알파포울드’ 최고 성적 획득해
과학자들은 단백질의 3D 구조를 파악하기 위해 x-선 결정학, 극저온 전자현미경(cryo-EM)과 같은 실험 기술을 적용해왔다.
그러나 성과는 여전히 미진했다. 그동안 연구자들이 구조를 밝혀낸 단백질은 생명체에서 발견한 2억여 개의 단백질 중 약 17만 개에 불과했다.
이런 문제를 인공지능(AI)이 해결한 셈이다. 알려진 것처럼 딥마인드는 인공지능 ‘알파고’를 개발한 기업이다.
딥마인드는 단백질 분석을 통해 ‘알파포울드(AlphaFold)’란 명칭의 알고리듬을 개발했다. 그리고 방대한 데이터 저장소에서 단백질 서열 및 구조 패턴을 발견하기 위한 훈련을 학습하고 있었다.
CASP에 처음 참여한 것은 2018년이다. 처음 참가하면서 단백질 구조에서 평균 15%의 경쟁에서 이기고 가장 어려운 대상(단백질)에 대해 최대 약 60점의 점수를 획득하는 등 놀라운 성적을 획득했다.
그러나 딥마인드 측에서는 ‘알파포울드’의 예측이 여전히 너무 거칠어서 실제로 사용하기에는 적절치 않다고 판단했다. 그리고 더 나은 결과를 얻기 위해 사람이 직소 퍼즐을 조립하는 방식을 모방해 기능을 보강했다.
작은 덩어리인 아미노산 클러스터로 조각을 연결한 다음 더 큰 전체적인 덩어리로 결합하는 방식이다. 17만 개 이상의 단백질 구조 모두에 대해 알고리즘을 가동하는 기계학습을 진행했는데 매우 효과적이었다.
그리고 올해 CASP에서 ‘알파로울드’는 92.4점의 점수를 달성했다. 가장 까다로운 단백질의 경우에서도 뛰어난 능력을 발휘했다. 그동안 X-선 결정학으로 해결하기 힘들었던 세포막에 갇힌 단백질의 구조를 해결하는 데 있어서도 탁월한 능력을 발휘했다.
영국왕립 학회 회장인 구조생물학자 벤키 라마크리슈난(Venki Ramakrishnan) 박사는 딥러닝의 연구 결과가 “단백질 접힘 문제를 해결하는 데 있어 놀라운 발전”이라고 평가했다.
딥마인드 측은 아직 ‘알파포울드’가 완전히 성공을 거둔 것은 아니라고 설명하고 있다. 일부 단백질에서 왜곡이 일어났고, 일부 단백질에서는 만족스러운 결과를 얻지 못했다며, 향후 훈련을 통해 단백질 복합체를 총체적으로 분석해 예측하기 위한 능력을 보강해나가겠다고 밝혔다.
- 이강봉 객원기자
- aacc409@hanmail.net
- 저작권자 2020-12-03 ⓒ ScienceTimes
관련기사

 뉴스레터
뉴스레터