암에 걸린 사람은 누구든 의사로부터 “안타깝게도 암이 전이됐습니다”라는 말을 듣고 싶어하지 않는다. 그러나 암은 환자가 모르는 사이에 신체 중요 부위로 퍼져 결국 사망에 이르게 한다.
미국 조지아공대 연구팀은 쉽게 말해 암세포의 ‘다리를 부러뜨려’ 이동을 못 하게 함으로써 전이를 막는 새로운 방법을 개발했다.
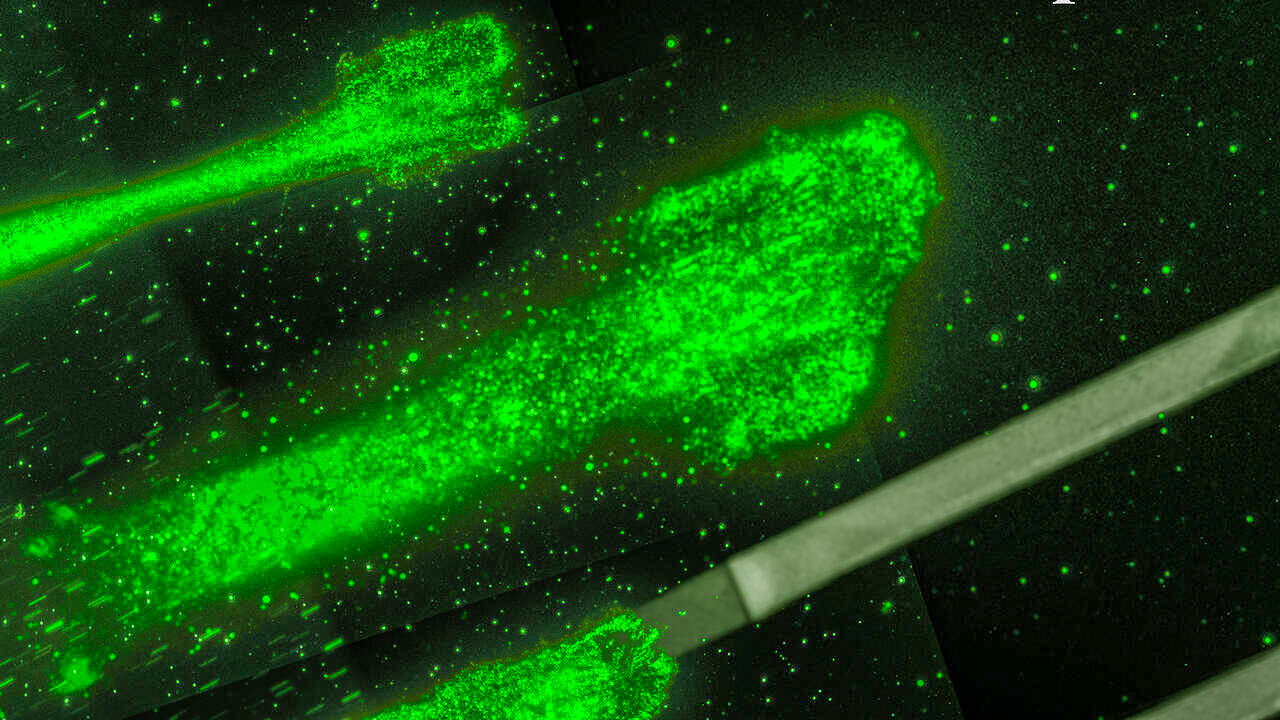
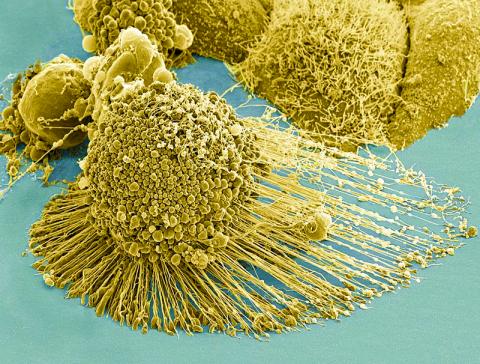
암세포는 종종 꺼칠꺼칠한 다리 같은 돌출부로 몸통을 덮어서 살금살금 움직인다. 연구팀은 미세한 금 막대를 레이저로 살짝 가열해 이 돌출부들을 훼손시키는데 성공했다. 이 치료법은 실험실 시험에서 암세포 전이의 핵심 메커니즘인 세포 이동을 막는데 큰 효과가 있는 것으로 밝혀졌다.
이 방법은 현재 암 전이를 제대로 막지 못 하는 의료 현실에서 의사들에게 치명적인 암세포 전이와 싸울 수 있는 새로운 무기를 제공할 수 있을 것으로 기대된다. 이 연구는 미 국립과학원 회보(PNAS) 26일자에 발표됐다.
연구를 이끈 모스타파 엘-사예드(Mostafa El-Sayed) 조지아텍 화학 및 생화학대 교수는 “암이 인체 한 부위에서 종양 상태로 머물러 있다면 거기에 접근해 제어할 수 있지만, 신체 여러 곳으로 두루 퍼진다면 치명적인 상태가 된다”고 말했다.
이 치료법은 암 세포를 쉽게 죽일 수도 있지만 이 실험에서는 실제 암세포 이동을 중단시키는지에 초점을 맞췄다.
부드럽게 암 전이를 멈추게 하기
이 실험적 치료법은 또한 사전 실험 결과 건강한 세포에 대해서는 영향이 없는 것으로 밝혀져 통상 쓰이는 화학요법보다 환자에게 미치는 부담이 훨씬 적을 것으로 보인다. 이전 쥐에 대한 실험에서 치료에 사용된 금 역시 독성 부작용을 나타내지 않았고, 저에너지 레이저로 인해 건강한 세포가 손상 받은 흔적도 발견되지 않았다.
연구팀은 무엇보다 치료된 암이 재발하지 않았다고 말했다.
엘-사예드 교수는 “이 방법은 치료된 종양으로부터 암이 퍼지지 않도록 차단하는 국소 투여요법으로 매우 효과적이며, 약한 레이저를 쓰기 때문에 필요할 경우 여러 번 사용할 수 있다”고 말했다.
암세포의 ‘다리’는 어떻게 작동하나
많은 사람들은 세포를 물이 찬 풍선과 같다고 생각한다. 그러나 이런 생각은 일부만 본 것이다. 세포에는 세포 형태를 부여하고 어떤 기능을 가진 세포 뼈대라는 지지 격자가 있다.

세포 뼈대는 또 세포 변두리에 있는 라멜리포디아(lamellipodia)라는 섬유질 조직에서 연장돼 나온 필로포디아(filopodia)라고 불리는 뻣뻣한 돌출을 형성한다. 이 돌출부는 일반적인 건강한 세포들이 자신이 속한 조직에서 위치를 이동시키는 것을 돕는다.
그러나 악성 암에서는 정상적인 건강한 세포의 기능이 종종 파괴적인 과잉상태로 바뀌어, 라멜리포디아와 필로포디아가 겉잡을 수 없이 과도하게 생성된다.
논문 제1저자인 유에 우(Yue Wu) 생물 분석 화학 전공 대학원생은 “이렇게 생성된 라멜리포디아와 필로포디아가 암세포의 다리가 된다”며, “암 전이는 암세포가 움직일 수 있는 돌출부가 필요하고 이런 돌출부가 많기 때문에 암세포가 다른 곳으로 퍼질 수 있다”고 설명했다.
끈적끈적한 금 막대의 작동 원리
작은 금 원자집합으로 구성된 금 나노막대는 암세포의 돌출부를 두 가지 방법으로 못 쓰게 만든다.
먼저 암세포의 다리 역할을 하는 돌출부 작동에 방해가 되는 부분에 국소적으로 도입된다. 금 막대는 인테그린(integrin)이라 불리는 일종의 세포 단백질에 특이적으로 달라붙게 하는 분자(RGD-펩타이드)로 코팅돼 있다.
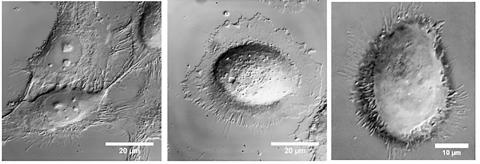
공동연구자인 얀 탕(Yan Tang) 박사후 과정 연구원(컴퓨터 생물학)은 “표적을 겨냥한 금 나노막대가 인테그린을 묶어 기능을 차단했기 때문에 세포 뼈대가 라멜리포디아와 필로포디아를 과잉 생산할 수 없었다”고 말했다. 실험에서 인테그림을 묶어두는 것만으로도 암세포 이동이 느려진 것으로 나타났다.
그러나 건강한 세포는 표적이 되지 않았다. 논문 공동제1저자인 무스타파 알리(Moustafa Ali)는 “암세포에는 과잉 생산되는 어떤 특정 인테그린이 있으나 정상세포에서는 그런 인테그린이 많지 않다”고 말했다.
온화한 온도로 레이저 가열
두 번째 단계에서 연구팀은 근적외선(NIR) 저에너지 레이저를 금 나노입자에 비췄다. 그러자 암세포 이동이 중단된 것으로 나타났다.
알리는 “빛이 세포에 흡수되지는 않았으나 금 나노막대가 빛을 흡수해 가열되면서 연결돼 있는 암세포를 부분적으로 녹이고 라멜리포디아와 필로포디아를 뭉개버렸다”고 말했다. 그는 “이 실험에서는 모든 암세포를 죽이지 않았다”며, “그랬다면 암세포 이동을 차단했는지 여부를 관찰할 수 없기 때문”이라고 설명했다. 물론 원할 경우 세포를 죽이는데 사용할 수도 있다.
더 뜨거운 레이저는 오히려 효과가 없었다. 알리는 “뜨거운 열로 인해 염증이 발생했기 때문에 한번 밖에 가열할 수 없었다”며, “고온으로 암세포가 완전히 제거되지 않기 때문에 일부 살아남은 암세포가 여전히 이동할 수 있었다”고 밝혔다.
롱후 우(Ronghu Wu) 연구원은 “부드러운 레이저는 피부를 태우거나 조직을 손상시키기 않으므로 여러 번 투사할 수 있고 암세포가 움직일 수 없도록 철저히 차단할 수 있다”고 말했다.
의학적 적용 가능성
연구팀은 현재 직접 혹은 국소 주사로 두경부암과 유방암 및 피부암을 치료할 계획을 세우고 있다. 이들이 사용하는 저전력 근적외선 레이저는 조직 아래 2~3㎝ 깊이에 있는 금 나노막대를 때릴 수 있으나 알리는 “4~5㎝ 깊이도 가능하다”고 한다.
더 깊이 있는 종양은 나노막대를 더 깊게 주입해서 치료할 수 있다. 엘-사예드 교수는 “광섬유나 내시경 레이저를 이용하는 방법이 있을 것”이라고 말했다. 나노막대를 혈류에 주입해 광범위한 치료제로 사용하는 것은 현재로선 실행 가능하지 않다.
엘-사예드 교수팀은 이전에 에모리대학팀과 함께 이 치료법을 쥐에게 실험한 결과 치료 후 15개월 지난 후에도 금에서 어떤 독성도 나타나지 않았다고 발표한 바 있다.
엘-사예드 교수는 “암세포가 다른 곳에 전이되지 않고 간과 비장에 머물러 있었다”며, “이들 장기의 기능은 그대로 유지됐고, 치료 받은 쥐들은 1년 넘게 건강하게 살아있다”고 밝혔다.
- 김병희 객원기자
- kna@live.co.kr
- 저작권자 2017-06-27 ⓒ ScienceTimes
관련기사

 뉴스레터
뉴스레터