후천성 면역결핍증(AIDS)을 일으키는 에이즈 바이러스(HIV)가 인체 세포를 감염시킬 때 사용하는 단백질 구조가 확실하게 규명돼 백신 개발에 중요한 교두보를 놓았다.
미국 스크립스 연구소(TSRI) 연구팀은 HIV 바이러스의 외피(外皮) 삼량체(三量體)[the envelope(Env) trimer]로 알려진 단백질의 본래 모습을 처음으로 밝혀내는데 성공하고, 이를 통해 바이러스를 무력화할 수 있는 항체의 접합 지점을 포함해 단백질 기저의 취약한 부분에 대한 세부 정보를 공개했다. 이 연구는 과학저널 ‘사이언스’(Science) 3일자에 발표됐다.
논문의 시니어 저자인 앤드루 워드(Andrew Ward) 조교수는 “이 단백질은 매우 연약해서 사진을 찍기 전에 분리돼 버려 그동안 제대로 된 정체를 알 수 없었다”며, “이제 본래 모습이 어떻게 생겼는지 알게 됐으므로 백신 개발이 한층 수월해질 것”이라고 말했다.
현재 시판이 허가된 에이즈 백신은 아직 없다. 2009년에 발표된 RV144의 임상실험은 에이즈 감염 위험을 30% 정도 떨어뜨리는 효과가 있는 것으로 보고돼, 과학자들은 더 효과적인 백신 개발을 위해 박차를 가하고 있다.

깐깐한 HIV의 방어체계
에이즈는 이전의 ‘치명적인 감염질환’에서 현재는 여러 약을 섞어 쓰는 칵테일 요법 등이 등장하며 ‘관리가 가능한 병'으로 인식되고 있다. 그러나 인간의 항체가 HIV 바이러스를 제압하기에는 난관이 많은 것으로 보인다. 항체가 이 바이러스를 무력화시키려 시도할 때 받는 도전은 가시철조망으로 뒤덮인 활주로에 비행기가 착륙을 시도하는 것과 비슷하다는 비유를 하기도 한다.
워드 교수는 “우리 면역체계가 에이즈 바이러스에 대응을 하지만 효과적으로 제압할 수는 없다”고 말했다.
이상적으로만 보면 우리 몸의 항체는 HIV의 Env 삼량체를 공격할 수 있다. 이 삼량체는 바이러스 외피로부터 툭 튀어나온, 세 개의 분자가 느슨하게 연결된 단백질로 바이러스가 이를 통해 숙주세포와 융합해 감염시키는 역할을 한다.
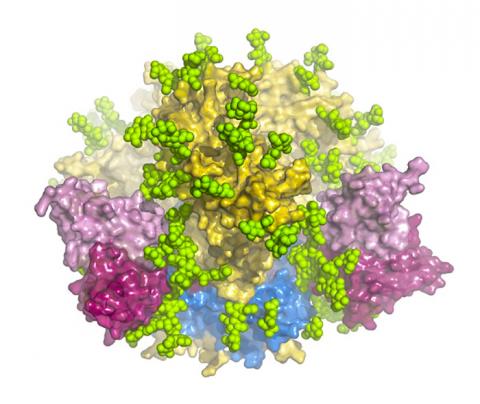
이 ‘융합 기구’(fusion machinery)도 공격해 볼 만한 타겟이다. 융합 기구의 구조는 잘 보호되고 있고 이는 여러 종의 바이러스가 같은 취약점을 안고 있다는 것을 뜻한다. 따라서 항체가 이 구역들을 공격하면 ‘광범위한 무력화’가 가능할 것으로 보고 있다. 그러나 애석하게도 글리칸(glycans)이라는 당(糖) 분자 방어막이 가로놓여 있어 항체가 이 구역에 도달하는 것을 막고 있는 상태.
이로 인해 HIV 백신을 개발하려는 연구자들은 글리칸에 대한 세밀한 정보가 필요했다. 세부 지도를 통해 방어막의 작은 구멍들을 발견하면 항체가 이를 통해 바이러스를 무력화시킬 수 있기 때문이다. 하지만 HIV의 삼량체는 매우 불안정해서 세부 정보를 담은 좋은 영상을 포착하기가 매우 어려웠다.
극저온 전자현미경으로 삼차원 영상 확보
연구진은 이번 연구에서 원자 수준까지 세밀하게 나타낼 수 있는 극저온 전자현미경(EM)과 3차원 영상기술을 활용했다. HIV의 조직 막에서 삼량체를 추출해 정제하는 방법을 고안해 삼량체를 얻은 다음 이를 현미경에 장착해 촬영을 시도했다. 이 과정에서 HIV 광범위 항체인 PGT151도 사용했다.
이렇게 얻은 영상들은 지금까지 나온 어느 것보다 더욱 완전한 삼량체 구조를 보여주었다. 바이러스가 세포를 침범할 때의 완전한 융합 기구와 복잡한 글리칸 및 MPER로 불리는 백신의 공격목표를 자세히 알 수 있었다. 또 삼량체가 늘어나는 속성이 있고 미묘하게 모양을 바꿀 수 있다는 사실도 증명됐다. 이 같은 모양 변화는 융합 기구의 일부분이면서 항체의 공격을 피하는 한 방법이기도 하다.
“이번 연구에 비추어 백신 개발 방향 옳아”
이와 함께 삼량체의 구조를 통해 PGT151 항체가 바이러스를 인식해 무력화시킬 때 접촉하는 취약지점인 가장 복잡한 항원 결정기도 처음으로 상세한 사진으로 촬영해 냈다. 이 사진에서 PGT151은 Env 표면의 여러 글리칸을 공격하는 외에 바이러스가 숙주세포를 감염시킬 수 없도록 융합 펩타이드에 결합하는 것으로 나타났다.
이번 연구는 관련 연구자들에게 글리칸 방어막을 뚫기 위해 항체가 어떤 특성을 가져야 하는지에 대한 아이디어를 제공해 준다. 논문의 제1저자로 워드 교수 연구실 박사과정 연구원인 이정현씨는 “HIV 백신을 개발할 때 이 점은 특히 중요하다”고 강조했다.
워드 교수는 이번에 확인된 Env 삼량체 구조가 현재 과학자들이 백신 개발에 활용하고 있는 모의 삼량체 구조와 비슷한 점에 비추어 백신 개발이 올바른 방향으로 가고 있다고 덧붙였다.
- 김병희 객원기자
- kna@live.co.kr
- 저작권자 2016-03-04 ⓒ ScienceTimes
관련기사

 뉴스레터
뉴스레터




















