여러 유형의 암에서 암세포가 제멋대로 성장하는 메커니즘에 제동을 걸 수 있는 방법이 미국 연구팀에 의해 개발됐다.
미국 미시간대(U-M) 로겔 암센터와 케이스웨스턴리저브대 종합 암센터 연구팀은 암 성장 결합 부위(binding site)를 확인해 이곳에 약물을 투여함으로써 암 억제 기전을 활성화할 수 있는 새로운 방안을 발견했다.
연구팀은 생명과학저널 ‘셀’(Cell) 20일 자에 발표한 논문에서 이번 발견이 현재 널리 쓰이고 있는 종양 억제 단백질 족의 활성을 향상시키는 새로운 종류의 항암제 개발에 중요한 교두보를 마련했다고 밝혔다.
첨단 저온전자현미경으로 결합 부위 확인
과학자들은 특정 분자들이 종양 억제 단백질인 탈인산화효소(PP2A)의 활성을 증가시킨다고 생각해 왔다. PP2A(Protein phosphatase 2)는 인체 세포주와 동물 모델에서 암세포를 죽이거나 위축시키는 것으로 알려져 있다.
그러나 지금까지는 신체 어떤 부위에서 이 분자들이 PP2A 단백질과 상호 작용하는지에 대한 아무런 정보가 없었다. 이 때문에 과학자들은 열심히 분자들의 속성을 최적화해 항암제를 개발해 보려고 노력했으나 끊임없이 시행착오만 되풀이해 왔다.
연구팀은 바로 이런 상황에서 새로운 돌파구를 연 것.
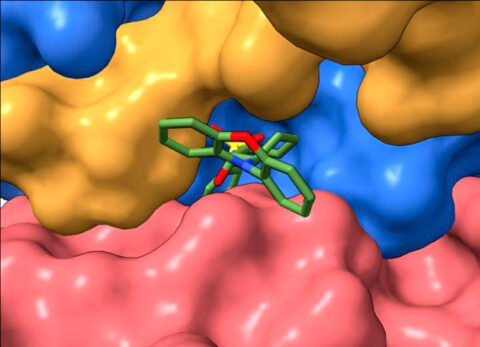
논문 공동 시니어 저자로 케이스웨스턴리저브대 부교수인 데렉 테일러(Derek Taylor) 박사(약리학 및 생화학)는 “첨단 저온전자현미경 관찰법(cryo-electron microscopy)을 사용해 PP2A에 결합된 도구-분자인 DT-061의 3차원 이미지를 얻을 수 있었다”고 밝히고, “이를 통해 처음으로 이 단백질의 다른 부위들이 어떻게 화합물과 결합하고 안정화될 수 있는지를 정확히 관찰할 수 있었다”고 밝혔다.
테일러 교수는 “앞으로 이 정보를 이용해 우리가 원하는 프로파일과 함께 치료제로 활용하기 위한 특이성과 효능을 지닌 화합물 개발을 시작할 수 있다”고 덧붙였다.
연구팀은 이런 종류의 PP2A 소분자 활성체(SMAPs, small molecule activators of PP2A)를 확보할 필요가 있다고 제안했다.
암과 함께 심혈관질환이나 신경퇴행성 질환을 포함한 많은 질병에서도 PP2A가 제대로 조절이 되지 않아 병을 일으키는 것으로 여겨지고 있다.
연구팀은 이런 맥락에서 이번 연구 결과가 심부전이나 알츠하이머병과 같은 여러 질병의 치료제 개발에도 도움을 줄 것이라고 낙관하고 있다.
팀 사이언스의 개가
논문 공동 시니어 저자이자 미시간대 내과 유전의학부 책임자인 구섬 나를라(Goutham Narla) 교수는 이번 연구에는 과학 분야와 전문 분야의 긴밀한 협력이 밑바당이 됐다고 말했다.
나를라 교수는 “이번 연구 결과는 과학자들이 여러 해 동안 풀기 위해 노력해 온 의문들을 협동과 팀 과학을 통해 어떻게 해결하는가를 보여준 한 폭의 그림과 같다”고 말하고, “암에 대해 어떻게 최상으로 적용할 것인지에 대한 생물학적 지식 없이 구조를 해결한다는 것은 이야기의 절반에 지나지 않는다”고 지적했다.
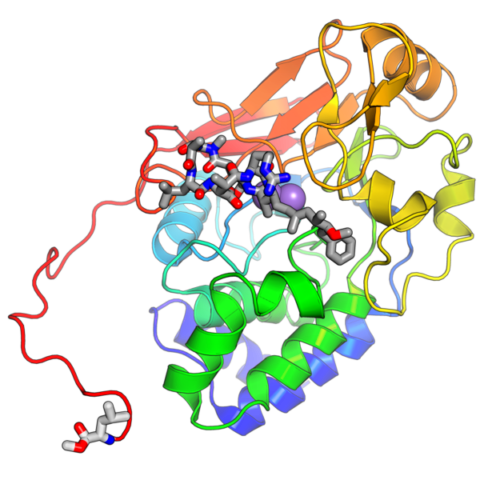
또한 그는 “구조적 데이터 없이 PP2A만을 활성화시켜 암세포를 죽이고 성장을 지연시키는 것 역시 반쪽 이야기에 지나지 않는다”며, “우리는 협동을 통해 이전에 약으로 통제할 수 없었던 종양 억제자를 약으로 조절할 수 있다는 이야기를 하게 됐다”고 밝혔다.
이번 연구에는 케이스웨스턴리저브대 케이스 종합 암센터 박사 과정 의사인 대니얼 레너드(Daniel Leonard) 연구원과 테일러 교수 연구실의 웨이 황(Wei Huang) 박사가 논문 제1저자로 연구를 주도했다.
“암과 기타 질병 치료 위한 교두보”
최근 몇 년 동안 의학계에서는 인산화 효소인 키나아제(kinase) 억제제 개발을 둘러싸고 많은 성과가 있었던 것으로 알려진다.
키나아제 억제제는 소분자 화합물로, 단백질 키나아제를 뒤쫓아가는 성질이 있다. 이 단백질 키나아제에 기능 장애가 생기면 암세포의 폭발적 성장과 증식에 관여하게 된다. 키나아제 억제제는 이런 암세포의 ‘작동 스위치(on switch)’를 끄게 된다고 레너드 연구원은 설명했다.
이번의 새로운 연구는 방정식의 반대편에서 암의 ‘멈춤 스위치(off switch)’를 작동시켜 암을 공격한다. 단백질 포스포타아제의 기능이 잘못되면 암 성장의 핵심 브레이크가 제거되기 때문에 이를 안정화시키는 것이다.
논문에서 연구팀은 단일 접근법을 시도했을 때 이를 방해하는 암의 진화 능력을 극복할 수 있도록, 동시에 두 가지 접근법을 원투 펀치로 날릴 수 있는 조합법이 도움을 줄 것이라고 제안했다.
황 박사는 “우리가 확인한 결합 포켓은 병원에서 암과 다른 질병 치료에 쓰일 수 있는 차세대 SMAP를 최적화할 수 있는 교두보를 제공한다”고 강조했다.
- 김병희 객원기자
- hanbit7@gmail.com
- 저작권자 2020-04-28 ⓒ ScienceTimes
관련기사

 뉴스레터
뉴스레터



















