숨을 쉬는 기도가 막혀 폐기능이 서서히 떨어지는 만성 폐쇄성 폐질환(COPD)은 세계에서 네 번째로 큰 사망 원인으로 꼽힌다.
담배 같은 유해한 입자나 가스를 흡입해, 폐에 비정상적인 염증 반응이 일어나면서 서서히 기류가 제한되는 호흡기병이다.
이 병이 생기는 주요 원인은 유전적 요인과 흡연, 석탄가루 같은 작업성 분진과 화학약품의 지속적 흡입 등으로 보고 있다. 이와 함께 환기가 제대로 되지 않는 공간에서의 조리와 난방도 관계가 있는 것으로 알려져 있다.
미국 앨라배마대(버밍햄) 연구팀은 최근 COPD의 원인을 세포 수준에서 구체적으로 찾아내 의학계의 관심을 모은다. 만성 염증과 조직 파괴 사이에 근본적인 연관성이 있는 새로운 병원체(pathogenic entity)를 발견한 것.
이 병원체는 활성화된 호중성 과립구, 즉 다형핵 백혈구(PMNs)에서 유래된 엑소좀(exosomes)으로 밝혀졌다.
엑소좀은 진핵생물의 혈액, 소변, 뇌척수액 같은 체액에 존재하는 30~100나노미터 크기의 세포 유래 소포(vesicle)로, 세포간 신호 전달 등에 중요한 역할을 하는 것으로 알려져 있다. 이를 질병의 예후와 진단, 치료 및 생체표지자로 활용하기 위해 최근 과학자들의 관심이 크게 높아지고 있다.
엑소좀 옮겨 넣자 COPD 발병
연구팀은 정제된 PMNs에서 수집한 작은 엑소좀 아세포 입자들을 건강한 생쥐의 폐에 주입해 COPD 손상이 일어나는 것을 확인했다.
또 COPD 환자와 기관지폐형성 이상이 있는 신생아의 폐 체액으로부터 수집한 엑소좀을 건강한 생쥐의 폐에 집어넣자 똑같이 COPD 폐 손상이 발생했다. 이 손상은 주로 인체 폐에서 나온 PMNs 유래 엑소좀에 의한 것이었다.
에드윈 블레이락(J. Edwin Blalock) 앨라배마대 의대 교수(폐, 알레르기 및 중환자 의료)는 “이번 보고는 비감염으로 정의된 아세포체를 사람으부터 생쥐로 옮겼을 때 이 세포체가 질병 표현형을 재현할 수 있는 능력이 있다는 증거를 처음으로 보여주었다”고 말했다.
그는 “이번 발견은 매우 심오한 의미를 지닌 것으로, 이 연구에서 발견한 많은 사항들은 질병에 따라 다른 세포조직에도 적용될 수 있을 것”이라고 전망했다.
면역세포 염증과 조직 파괴로 나타나는 다른 질병들에는 심장 발작, 전이성 암 및 만성신장질환이 포함된다.
활성화된 PMN 엑소좀은 또한 낭포성 섬유증 같은 과도한 PMN 유발 염증을 나타내는 다른 폐질환에서 폐 손상을 일으킬 수 있다.
6년 간에 걸쳐 진행한 이번 연구는 생명과학저널 ‘셀’(Cell) 10일자에 보고됐다.
미 국립보건원 산하 국립 심ᆞ폐ᆞ혈액연구원 폐질환 부문장인 제임스 킬리(James Kiley) 박사는 “이번 발견은 만성 폐질환에서 선천 면역반응의 새로운 역할을 강조하는 한편, COPD와 낭포성 섬유증의 새로운 진단 및 치료법 개발에 활용될 수 있다”고 평가했다.
엑소좀의 단백질분해효소 수용능력 연구
흡연 관련 질환인 COPD는 폐에 PMN 촉발 염증이 나타나는 것이 특징이다. 폐 조직 손상은 기도 폐색과 호흡 곤란 및 호흡 부전으로 이어진다. 호중구라고도 알려진 PMN 면역세포는 감염과 조직 손상에 대항하는 인체 백혈구 방어체계의 일부를 형성한다.
호중구는 인체 백혈구의 60%를 구성하며, 피 1리터에 약 53억개가 들어있다. PMN은 병원체가 침입했다는 신호를 받고 활성화되면 미생물이나 손상된 인체 세포를 먹어 치운다.
모든 세포들은 엑소좀을 배출한다. 이 작은 세포 밖 막-결합 소포는 세포 간 통신의 중재자 역할을 하며, 세포에서 세포로 단백질과 지질, 핵산 등 다양한 화물을 운반하는 역할을 한다.
연구팀은 최근 엑소좀에 대해 새로 밝혀진 세 번째 역할인 단백질분해효소(프로테아제)를 수용할 수 있는 능력에 중점을 두었다.
활성화된 PMN은 1형 콜라겐과 엘라스틴을 분해할 수 있는 프로테아제인 호중구 엘라스타아제(NE)를 분비하는 것으로 알려져 있다. 콜라겐과 엘라스틴 단백질은 세포들을 함께 붙어있게 하는 세포외 기질을 형성하는데 도움을 준다.
폐에서 세포외 기질과 폐 세포들은 산소와 이산화탄소를 교환하는 작은 폐포를 형성하는 조직 시트들이다. 그런데 COPD 폐에서는 손상된 폐포가 확장돼 산소 교환이 줄어들게 됨으로써 심장이 폐로 혈액을 밀어내는 것이 더욱 힘들어진다.
NE와 PMN의 다른 프로테아제는 미생물을 공격할 수 있다. 때문에 건강한 폐는 프로테아제를 억제할 수 있는 항프로테아제에 의해 보호된다. 일반적으로 NE는 폐에서 강력한 알파1-항트립신 장벽으로 차단돼 있다.
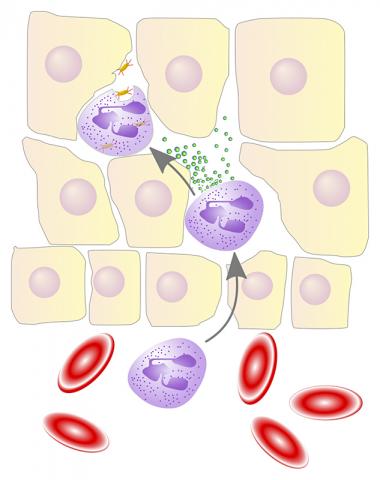
활성화된 PMN 엑소좀을 어떻게 막을까
블레이락 교수팀은 NE가 엑소좀 형태로 존재할 수 있는지, 그리고 그런 엑소좀이 염증성 폐질환을 일으키기 위해 알파1-항트립신 장벽을 우회할 수 있는지 여부를 조사했다.
연구팀은 정지상태의 PMN에서 나온 엑소좀은 건강한 쥐로 옮겼을 때도 COPD를 일으키지 않는다는 것을 발견했다.
반대로 활성화된 상태의 PMN 엑소좀은 COPD를 유발했다. 이것은 폐포의 조직학적 변화로 측정됐다. 이 변화에 따라 폐의 저항성이 증가되고 폐로 피를 뿜어보내는 우심실이 확대됐다.
활성화된 PMN 엑소좀은 효소적으로 활성화된 표면-결합 NE로 뒤덮였고, 반면 정지상태의 PMN 엑소좀을 자취를 감췄다.
이 표면 NE는 알파1-항트립신 장벽에 저항성을 나타냈다. 활성화된 PMN 엑소좀은 콜라겐을 분해하는 한편 생쥐의 폐에 투여했을 때 폐기종을 일으켰다. 이들은 PMN 세포-표면 표지자인 CD63과 CD66b를 가지고 있어 PMN에서 유래된 것으로 확인됐다.
그런 PMN 세포-표면 표지자들을 갖고 있는 인체 COPD폐-유래 엑소좀들은 쥐에서 COPD를 일으켰다.
알파1-항트립신 장벽을 압도할 만큼 많은 양의 정제된 NE는 생쥐에서 폐포를 확장시킬 수 있다.
엑소좀-결합 NE는 알파1-항트립신 저해로부터 보호를 받기 때문에, 연구팀은 정제된 NE와 동일한 폐 손상을 일으키는데 필요한 활성화된 PMN 엑소좀의 양은 1만배 이하임을 발견했다.
활성화된 PMN 엑소좀은 표면에 인테그린 Mac-1을 가지고 있어 공격적 단백질 분해의 또다른 원인으로 확인됐다.
인테그린 Mac-1은 엑소좀이 직접 콜라겐 섬유에 결합하도록 함으로써 NE 보호 이외에 단백질 분해 엑소좀이 크기와 프로테아제 운반과 관련해 왜 커다란 분해능을 발휘하는지에 대한 두 번째 메커니즘을 나타내 준다.
블레이락 교수는 “이번 연구 결과는 그동안 염증, 단백질 분해, 세포 기질 리모델링 사이의 상호작용에 대해 전혀 평가되지 않았던 측면을 나타내 주며, 향후의 연구에 광범위한 영향을 미칠 것”이라고 말하고, “우리 보고서는 엑소좀의 생물학적 내용 목록을 크게 확장시켜 이 세포외 입자의 강력한 생물학적 영향력을 입증해 준다”고 강조했다.
세 가지 치료 전략
이번 연구는 PMN 액소좀의 기능의 병원성 측면을 차단하기 위한 다음과 같은 치료 전략을 제안했다.
먼저, NE를 축출내고 알파1-항트립신에 반응하도록 하기 위해 엑소좀과 NE의 이온 결합을 방해한다. 두 번째로는 엑소좀 인테그린 Mac-1이 콜라겐 결합을 차단하는 것을 막는다. 세 번째는 소분자 화합물로 엑소좀 NE를 직접 차단한다.
블레이락 교수는 또한 건강한 흡연자에게서는 엑소좀이 어떻게 활동하는지 큰 의문을 가지고 있다.
그는 “7~8명의 흡연자 중 한 사람만이 COPD에 걸린다”며, “흡연자 그룹에서 활성화된 PMN 엑소좀을 발견한다면 놀라운 결과가 나올 것”이라고 말했다.
그럴 경우 흡연자들은 자신들이 직면한 위험에 대해 확실한 경고를 받을 수 있을 것이다.
- 김병희 객원기자
- hanbit7@gmail.com
- 저작권자 2019-01-14 ⓒ ScienceTimes
관련기사

 뉴스레터
뉴스레터





















