인류의 최대 염원으로 불린 암 정복. 그동안 암 선고를 받은 많은 사람들이 속수무책으로 무장해제를 당해야 했지만 최근에는 현대 의학과 과학기술이 발전하면서 암 정복에 대한 앞길이 서서히 열리고 있다.
이런 가운데 카이스트 전상용 교수 연구팀이 금나노 입자를 이용한 항암 백신 원천기술을 개발, 해당 연구결과가 독일 학술지 '앙케반테 케미(Angewandte Chemie)'지 7월호에 게재돼 국내 항암백신 기술을 한 단계 끌어올렸다는 평을 받고 있다.
항암백신 이상적인 필수요건 갖춰
암은 현대의학이 정복하지 못한 대표적 난치성 질환 중 하나로, 전 세계적으로 한 해 3천만 명의 암환자가 발생하고 있으며 국내에서는 매년 사망원인 중 1위를 차지하고 있다.
암 치료에 있어 정상세포까지 죽이는 세포독성의 부작용을 최소화하고 효과를 극대화할 수 있는 면역치료법인 백신이 전 세계적 추세인데, 기존의 항암백신은 제조과정이 여러 단계이고 치료비도 비싸다는 단점을 안고 있다. 또한 몸속에 주입한 백신이 원하는 곳에 얼마나 도달했는지 추적할 수 없어 치료효과를 가늠할 수 없다.
그러나 이번 전상용 교수 연구팀의 금나노 입자 항암백신 원천기술은 이상적인 항암백신의 두 필수요건을 갖추고 있다.
“암을 치료하거나 예방하는 항암면역백신의 필수요건이 있다. 첫 번째는 암세포에 특이적으로 작용하는 항체 생산을 유도해야 하고, 두 번째는 실제적으로 암세포를 찾아가 제거할 수 있는 면역세포, 즉 T면역세포로 하여금 직접 암세포를 찾아가 제거하도록 해야 한다는 점이다. 암세포에 특이적으로 작용하는 항체생산 유도만으로는 암 치료 효과가 미미하므로 실제 암 세포를 제거할 수 있는 면역세포를 활성화하는 게 필요하다.”
기존 항암백신이 암 환자 개개인으로부터 말초 혈액을 뽑아내, 체외에서 면역세포를 활성화한 후 다시 해당 암 환자의 체내로 투여, T면역세포를 활성화시켜 특이적으로 암세포를 제거하는 방법이었던 데 반해, 전상용 교수팀의 금나노 입자를 이용한 항암백신 기술은 일반적인 근육주사를 통해 간단히 해결된다.
“이상적인 항암백신의 필수요건을 갖추기 위한 첫 걸음은 수지상세포라는 항원제시세포에 암 특이적 항원을 효과적으로 전달해줘야 한다는 것이다. 이것이 첫 번째 관문으로, 암 특이적 항원을 전달한 이후 T면역세포를 활성화 시켜줘야 한다. 가장 중요한 첫 과정이다.”
이를 위해 전 교수팀은 직접 우리 몸에 항암백신을 투여한 후, 수많은 국소 림프절(local Lymph Node)로 백신을 전달하는 방법을 택했다. 이것이 가장 좋은 루트기 때문이다.
근육주사로 주입하는 항암백신
“국소 림프절에 백신을 전달하는 이유는, 외부감염에 대한 면역 반응을 담당하는 첫 번째 수호진지역할을 국소 림프절이 행하기 때문이다. 이 림프절에는 대부분의 모든 면역세포들이 모여 있다. T면역세포와 B면역세포, 항원제시세포인 수지상세포까지 모인다. 면역세포와 수지상세포가 높은 밀도로 존재하고 있으므로 국소림프절로 백신을 전달해주면 백신이 수지상세포에 잡혀 수지상세포를 활성화하고 항원을 제시, 이후 T면역세포와 B면역세포를 활성화해 항체로 생산되기도 하고 활성화돼서 암세포를 제거할 수도 있다.”
국소림프절로 전달하는 방법은 위에서 언급했듯이 핏줄이 아닌 근육에 주사를 놓는 방식이다. 국소림프절은 겨드랑이와 목 등에 존재하는데, 우리가 감기에 걸리거나 피곤할 때 목에 편도가 붓는 등의 증상이 먼저 나타나는 것도 이곳에 박테리아가 모이기 때문이다. 그만큼 우리 몸에 대한 면역반응을 담당하는 데 중요한 역할을 한다고 볼 수 있다.
“우리 눈에는 보이지 않지만 몸에는 많은 림프관들이 있다. 매우 가는 관으로, 근육주사를 놓게 되면 물질들이 림프관을 타고 가장 가까이에 있는 림프절로 모이게 된다. 림프절로 물질들이 얼만큼 모일 수 있는가, 그 효과는 물질의 크기에 따라 달라진다.”
전 교수팀은 직경 약 10나노미터의 금나노 입자 표면에 암세포에 과발현되는 특이적 항원들을 결합시킨 후 추가적으로 수지상세포를 활성화시킬 수 있는 면역보조제를 항원에 추가적으로 접목시켰다. 이때 사용한 면역증강제(면역보조제)는 DNA의 짧은 조각으로, 이는 면역시스템을 활성화하는 역할을 한다.
환자에 따라 암의 종류가 모두 다르므로 이런 원리로 해당 환자의 암 특이적 항원을 금나노 입자 표면에 붙여 주입하면 된다. 기존의 항암백신보다 쉽고 간단한 백신 제조 공정이 가능해진 셈이다.
그렇다면 왜 금나노를 이용해 항암백신을 만들었을까. 이에 대해 전 박사는 CT 등으로 추적이 가능하다는 점을 들었다.
“금나노 입자를 사용하는 이유는 여러 가지가 있다. 우선 금은 CT 촬영시에도 육안으로 볼 수 있으므로 추적이 가능하다는 점이 있다. 얼마큼, 어디로 전달됐는지 확인이 매우 용이하다. 두 번째는 국소림프절로 항암백신이 전달될 때 가장 중요한 것이 크기인데 금나노 입자는 얼마든지 크기를 조절할 수 있다. 또한 나노 입자 표면에 암 특이적 항원을 코팅해야 하는데 금 나노 입자가 항원 코팅이 쉽게 된다. 더불어 금은 생체에 적합하기 때문에 안전성까지 갖추고 있다.”
동물실험으로 효과 입증
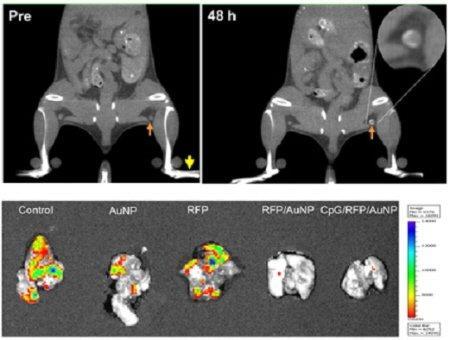
이렇게 진행된 연구는 동물연구를 통해 여러 가지 효과를 입증했다. 연구팀이 실행한 동물실험은 총 세 가지로, 암 예방효과와 암 전이효과, 암 치료효과가 바로 그것이다.
먼저 암 예방효과를 알아보기 위해 연구팀은 일주일 간격으로 총 3주에 걸쳐 생쥐의 발바닥에 금 나노 입자 백신을 주입했다. 백신을 투여해 항체를 생성한 뒤 추후 암 세포를 체내에서 만났을 경우 과연 암이 생성되는지를 알아보기 위한 것이었다.
실험 결과 다른 대조군은 10일을 기점으로 암 크기가 급격하게 늘어났지만 금 나노 입자를 투여한 백신 그룹은 30일까지 전혀 암이 커지지 않고 그 이후에도 매우 서서히 크기가 커지는 것을 확인할 수 있었다.
암 전이 실험 역시 그 효과는 입증됐다. 동물실험을 통해 폐로의 암 전이를 얼만큼 막아주는지 알아본 결과 차이가 확연했다. 실험을 위해 동물의 정맥에 암 세포를 직접 주사한 후 폐 근처에서 증식한 암 덩어리를 관찰했다. 여러 가지 대조군과 비교해 본 결과, 금나노 백신그룹은 4~5배 정도 암 전이를 효과적으로 차단했다.
그렇다면 해당 백신을 예방차원에서 접종할 경우, 암 예방에 큰 효과를 볼 수 있을까. 전상용 교수는 불가능하진 않으나 암이 워낙 복잡하고 다양하므로 큰 기대효과를 볼 수 있을지는 미지수라고 말했다. 항암백신은 사람에게 발현된 특정 종류의 암에 특이적으로 작용해야 효과가 있는데, 예방접종으로 주입한 항암백신의 항원과 이후 발생한 암의 항원이 다르면 효과가 없기 때문이다.
“항암백신을 예방차원에서 접종할 경우 암 예방이 될 수는 있겠지만, 면역세포의 기억기능이 오래가지 않으므로 항암백신을 예방용으로 개발한다면 아마 주기적으로 접종해야 할 것이다. 또한 항암백신을 접종했다 해도 해당 항원의 위암은 막을 수 있지만, 다른 항원을 가진 위암은 예방할 수 없다. 따라서 예방 암 백신이 유효할지라도 큰 효과는 기대하기 힘들다.”
3년 반 연구의 쾌거
전상용 교수팀은 본 연구를 본격적으로 진행한 기간만 3년 반의 시간을 투자했다. 또한 전 교수뿐 아니라 연구팀원 중에는 면역관련 연구를 해본 사람이 없어 광주과학기술원(전상용 교수는 얼마 전까지 광주과학기술원에서 연구 활동을 했다)을 오가며 면역 관련 공부를 병행했다. 아이디어만 갖고 뛰어든 연구였던 셈이다. 전 교수 스스로도 처음 연구를 시작할 당시를 ‘맨땅에 헤딩하는 수준’이라고 말할 정도였다.
“전공분야는 아니지만 항암치료가 앞으로 갈 길은 백신이라고 생각했다. 그러던 차에 나노 기술이 있어야만 접목될 수 있는 백신기술이 있다는 것을 알았고 자연계에 존재하는 바이러스를 흉내낸 나노입자를 만들면 효과가 있을 것이라고 생각했다. 우리가 가진 나노 기술로 자연계의 바이러스를 본 따 백신을 개발하면 좋은 결과가 나올 수 있을 것이라고 여겼다.”
실제로 바이러스 크기는 30나노미터 정도로 나노 입자처럼 동그란 표면에 단백질들이 규칙적으로 배열돼 있다. 때문에 바이러스로 예방접종을 할 경우, 림프관을 타고 림프절로 들어가 면역반응을 유도하는 것이다. 따라서 전 교수는 바이러스와 가장 유사하게 흉내낸 나노입자를 만들면 이상적인 항암백신을 만들 수 있다고 생각한 것이다.
전 교수는 이번 연구가 기존 암 치료와 비교했을 때 이룬 가장 큰 성과로 가격을 꼽았다. 항암요법은 부작용으로 인해 추가적인 항암제가 나오지 않는 상태이며 이후 개발된 항암백신 역시 비용이 너무 고가여서 가격대비 효과가 뛰어나지 않다는 단점이 지적됐기 때문이다.
“기존의 항암백신은 세포치료제였는데, 그 한계는 너무 고가라는 점이다. 때문에 암 환자들이 쉽게 이용할 수 없었다. 하지만 우리 기술은 직접 주사를 통해 국소 림프절로 전달하는 항암백신이므로 개발된다면 범용적으로 사용할 수 있을 것이다. 그렇게 되면 암 치료 방법이나 기술에 한 가지 방안을 더 추가한 셈이 되는 것이다. 따라서 암 환자의 생존율이나 삶의 질을 높이는 데 큰 역할을 할 것이라고 본다.”
해당 연구기술은 금나노 입자 표면의 항원만 바꿀 경우, 현재 임상적으로 치료가 어려운 바이러스성 질환인 C형 간염과 HIV(에이즈 바이러스)에도 응용해 사용할 수 있을 것으로 기대되고 있다. 전 교수는 이 연구가 항암백신의 한 후보군을 만든 것에 지나지 않으므로 다양하게 최적화된 시스템으로 접근한 후에 해당 시스템을 통해 에이즈 등의 분야에 응용할 계획이라고 전했다. 현재 HIV와 관련한 연구는 미국 예일대에 동물모델이 있으므로 공동연구 제안을 할 예정이다.
“나는 연구를 위한 연구에는 관심 없다. 사람에게 쓰일 수 있는 연구가 목적이다. 따라서 해당 기술을 제약회사들과 함께 고민해 실제적인 개발이 되도록 하고, 임상에 쓰일 수 있는 백신으로 개발하는 것이 앞으로 기대하고 있는 부분이다.”
- 황정은 객원기자
- hjuun@naver.com
- 저작권자 2012-09-14 ⓒ ScienceTimes
관련기사

 뉴스레터
뉴스레터












