모든 생명체는 자신만의 생존 뿐 아니라 종족의 보존을 중요시 여긴다. 때문에 다음세대로 유전형질이 원활하게 전달되도록 하기 위해 유전정보를 안정적으로 보호하고자 한다. 이를 위해 유전체는 항상 안정성 있게 유지돼야 하지만 내부적 또는 외부적 요인에 의해 DNA는 항상 손상에 노출돼 있다.
DNA를 손상시키는 대표적인 물질은 정상적인 대사과정에서 생성되는 활성산소다. 하지만 외부 요인에 의해서도 DNA는 훼손된다. 지난 2011년 발생한 일본 후쿠시마 제1원자력 발전소 사고의 경우 대표적인 외부 요인이라고 할 수 있다.
손상된 DNA가 복구되지 않을 경우 이는 결국 유전체 불안정성(Genomic Instability)을 일으키고 여러 병상의 원인이 된다. 암이나 노화를 촉진하는 것이다. 이러한 위험을 방지하기 위해 생명체는 손상된 유전자를 인식하고 복구하는 다양한 방어기전을 갖는다.
유전정보 항상성을 지키는 방법
국내 연구진이 보안관 단백질의 새로운 기능을 찾아내 주목을 받고 있다. 이영수 아주대 의대 교수팀이 미국 성유다 어린이 연구병원(St. Jude Children's Research Hospital)과 공동으로 연구를 수행, DNA에 담긴 유전정보 항상성을 지켜주는 보안관 단백질의 신경세포에서의 새로운 기능을 찾아냈다. 유전체 손상이 복구되지 못하면 신경퇴화를 동반하는 질환으로 이어질 수 있는 만큼 향후 관련 질환을 이해하는 데 기여할 것으로 기대되고 있다.
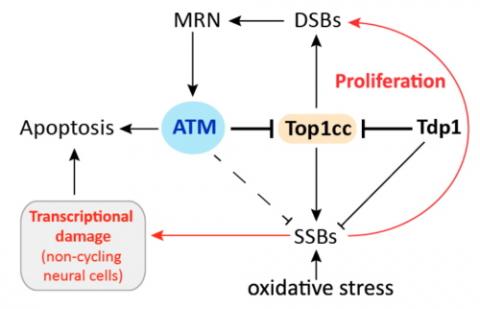
이영수 교수팀은 연구를 통해 신경세포에서 틸로미어 이상을 인식하는 단백질 ATR로부터 ATM(Ataxia telangiectasia and Rad3 related)이 신호를 받아 신경세포 사멸을 조절하는 것을 알아냈다. 그동안 ATM은 DNA 이중나선절단 복구에만 관여하는 것으로 알려져 있었다. ATM과 신경세포 퇴화와의 연관성은 알려져 있긴 했지만 정확한 분자기전에 대해서는 전해지지 않은 상태였다.
"DNA 손상은 발생 즉시 인지돼야 합니다. 단백질 인산화 효소인 ATM은 DNA 이중나선이 모두 절단된 상태를 즉시 인식하고 손상복구에 필요한 다른 단백질을 인산화 시킴으로써 복구 신호를 전달합니다. 또 다른 단백질 인산화 효소인 ATR은 DNA의 단일나선이 비정상적으로 길게 노출되는 것을 즉시 인식해요. ATM과 비슷하게 손상복구에 관여하는 다른 단백질을 인산화 시켜 DNA를 정상적인 구조로 복구시키죠. 세포내에서 ATM과 ATR은 이른바 보안관 단백질로 DNA에 손상이 생겼는지 항상 점검하고 적절한 조절 기전을 활성화 시키는 역할을 합니다."
하지만 이러한 보안관 단백질에 이상이 생기면 희귀 유전병이 발생할 수 있다. 일례로 ATM 유전자 돌연변이는 유전병인 '모세혈관확장성 운동실조증' 을 일으킨다. 면역계 이상, 불임, 발암 등 여러 가지 복잡한 병증을 보이고 가장 두드러지게는 소뇌의 신경세포를 퇴화시켜 운동실조를 일으키는 것이다.
"대부분의 환자는 열 살을 전후해 휠체어에 의지하게 됩니다. 현재까지 ATM의 불활성화가 소뇌에 어떻게 선택적으로 신경세포 퇴화를 일으키는지, 이에 대한 이해는 아직 부족합니다. 다만 최근에는 기존 ATM의 기능이 DNA 이중나선 절단 인식에만 국한되지 않는다는 게 조금씩 밝혀지고 있어요. ATR 유전자의 돌연변이도 소뇌증, 정신지체, 발달장애 등의 병상을 보이는 유전병인 세클 증후군(Seckel syndrome)의 원인이 되는데 발생과정 중 ATR이 없는 줄기세포가 DNA 손상으로부터 보호를 받지 못하기 때문에 이런 병상이 나타난다는 보고가 있습니다."
이외에도 학계에는 여러 가지 보고가 전해지고 있지만 DNA 손상 복구 이상과 신경계 병증, 특히 선택적인 신경세포 사멸의 분자세포생물학적 기전은 아직까지 알려진 게 없는 상황이다. 이영수 교수팀은 이러한 기전을 밝혀 새로운 접근법을 제시하고자 한 것이다.
"연구 결과 실제로 틸로미어(Telomere)가 손상된 생쥐는 소뇌부위에서 신경세포사멸이 일어났습니다. 반면 ATM이 만들어지지 않는 생쥐에서는 틸로미어 손상에도 불구하고 신경세포 사멸이 방지됐어요. 신호는 ATR을 통해 ATM으로 전달됐죠. 틸로미어는 복제과정 등에서 발생할 수 있는 염색체 말단손실로부터 유전정보를 보호하기 위해 각 염색체 말단에 존재하는 반복적인 염기서열을 의미합니다."
연구팀은 이와 별개로 ATM이 DNA 이중나선이 지나치게 꼬이는 것을 막는 Top1(DNA 이중나선 구조에 의한 물리적 긴장을 풀어주는 효소)이 제 역할을 마치고 DNA로부터 잘 분리되도록 도와 신경퇴화를 방지한다는 것을 알아냈다. 실제 Top1이 DNA에서 잘 분리되지 않는 생쥐모델에서 ATM이 만들어지지 않도록 한 경우, 이 둘 간의 비정상적인 결합이 더욱 심화되는 것으로 나타났다.
"진행된 연구는 기존에 밝혀지지 않은 ATM의 새로운 기능과 조절 기작을 실험동물 모델의 신경계 분석을 통해 얻은 결과를 보여주고 있습니다. 현재 ATM, ATR과 Top1의 기능은 생화학적 기법이나 세포 배양 기법을 통해 많이 연구가 되고 있을 뿐 아니라 새로운 기전과 조절기작이 지속적으로 발표되고 있습니다. 그러나 복잡한 세포 구성과 구조를 가진 신경계, 특히 뇌에서의 상기 단백질의 기능은 실험적 접근법의 한계 때문에 실험동물 모델을 이용해야 하는 어려움이 있어요. 저희 팀은 특정 유전자를 신경계에서 발생시키는 과정 중 선택적으로 불활성화를 시켜 병리학적 영향을 분석하는 접근법을 이용했습니다."
연구결과 이영수 교수팀은 기존에 알려진 사실과는 상반되게 ATM 또한 틸로미어 DNA 손상을 인식하고 신호전달 기전에 관여한다는 것을 알게 됐다. 이것은 예상치 않게 ATR에 의존적으로 조절 된다는 것을 의미했다. 타 연구진은 틸로미어도 보호가 되지 않으면 DNA가 손상돼 ATR에 의해 인식되지만 ATM은 이 과정에 관여하지 않는다고 언급했다.
유전체불안전성과 신경계 기능이상, 상관관계 밝힐 것
이영수 교수팀이 진행한 이번 연구의 가장 큰 특징은 기존에 알려진 결과보다 좀 더 세밀한 성과를 나타냈다는 점이다. 그는 "기존의 연구는 DNA 손상 인식과 복구 기전에 대한 이해를 많이 진척시켰지만 아직 신경계 이상과 밝혀진 기전과의 상관관계를 이해하는 것은 많이 부족한 상태"라고 언급했다.
"일반화된 기전을 그대로 적용하기에 신경계는 너무나 복잡한 구조와 구성을 갖고 있습니다. 발표된 논문에서 새롭게 증명된 사실들은 신경계만의 특별한 세포분자생물학적 기전을 유지하고 있다는 것입니다. 동시에 ATM의 신경계 내에서의 기능이 기존에 알려진 것보다 더욱 다양하고 복잡하다는 것을 보여주고 있죠."
연구를 진행하면서, 이영수 교수는 여러 가지 어려움에 직면하곤 했다. 무엇보다 실험동물을 이용해야 하는 연구였기에 발생할 수 있는 다양한 변수를 조절하는 게 관건이었다.
"신경계 연구에서는 실험동물의 신경계를 분석하는 게 기본입니다. 실험 결과 기존에 발표된 세포배양 실험과 차이가 있을 경우 어떻게 이런 차이가 생겼는지 다시 분석해서 보여줘야 하죠. 이는 실험동물을 이용한 실험, 특히 신경계를 분석할 때 자주 접하는 난관이에요. 기본적으로 세포배양 실험은 한 종류의 균일한 세포군을 이용해 진행되지만 신경계는 다양한 종류의 세포와 복잡 다양한 연결성을 가진 조직이라는 차이에서 기인해요. DNA 손상에 반응하는 신호전달 기전도 특이한 경우를 자주 보이곤 하죠. 이 차이를 실험적으로 증명하고 설명하는 것도 쉽지 않은데, 이 점이 가장 힘들었던 것 같아요."
이영수 교수팀의 이번 연구가 더욱 발전되고 진행된다면 추후 신경계 질병 중 신경퇴화 과정을 막을 수 있는 접근법을 개발하는 데 도움을 줄 수 있다. 아직 우리 학계는 모세혈관확장성 운동실조증 환자의 치료법을 개발하지 못한 상태로, 여러 증상을 완화시키는 조치를 취하는 게 최선의 치료법으로 불리고 있다. 가장 두드러진 병상인 운동실조의 원인이 되는 소뇌에서의 신경세포 퇴화를 막을 방법이 없는 상태인데 아직 그 이유는 명확하게 밝혀지지 않았다. ATM 기능 상실이 어떻게 선택적으로 소뇌에서 신경세포 퇴화를 유도하는지 모르기 때문이다.
"신경계 내에서 아직 밝혀지지 않은 ATM의 새로운 신호 전달 체계와 기능을 이번 논문을 통해 알림으로써 신경계 내 ATM의 기능을 이해하는데 새로운 방향을 제시할 수 있었습니다. 궁극적으로는 이런 발견을 통해 모세혈관확장성 운동실조증 환자의 신경계가 정상적으로 기능할 수 있는 방법을 찾는데 도움이 됐으면 해요. 나아가 다른 경우에도 발생하는 신경세포 퇴화 기전의 이해를 돕고 일반적으로 잘 알려진 신경계 질병 중 신경퇴화 과정을 막을 수 있는 새로운 접근법을 개발하는데 일조할 수 있길 바랍니다."
- 황정은 객원기자
- hjuun@naver.com
- 저작권자 2014-07-07 ⓒ ScienceTimes
관련기사

 뉴스레터
뉴스레터










